Hvad er mere sur benzoesyre eller o-acetylbenzoesyre?
Acetylgruppen (-COCH3) i o-acetylbenzoesyre er en elektrontiltrækkende gruppe. Det trækker elektroner fra benzenringen, hvilket gør hydrogenatomet på carboxylsyregruppen mere surt. Det betyder, at o-acetylbenzoesyre lettere vil miste sin hydrogenion (H+), hvilket resulterer i en lavere pH.
I modsætning hertil har benzoesyre ikke nogen elektrontiltrækkende grupper på benzenringen. Det betyder, at brintatomet på carboxylsyregruppen er mindre surt, og benzoesyre vil ikke miste sin hydrogenion så let som o-acetylbenzoesyre. Som følge heraf vil benzoesyre have en højere pH.
Forskellen i surhedsgrad mellem benzoesyre og o-acetylbenzoesyre kan ses i deres pKa-værdier. pKa for benzoesyre er 4,20, mens pKa for o-acetylbenzoesyre er 3,45. Den lavere pKa-værdi af o-acetylbenzoesyre indikerer, at den er mere sur end benzoesyre.
 Varme artikler
Varme artikler
-
 Forbindelse gør det muligt at styre bakteriel kommunikation af lysBestråling opsætning til at skifte den fotoswitchable modulator af bakteriel kommunikation fra trans-isomeren til den mere aktive cis-isomer. Kredit:Dusan Kolarski, University of Groningen Forsker
Forbindelse gør det muligt at styre bakteriel kommunikation af lysBestråling opsætning til at skifte den fotoswitchable modulator af bakteriel kommunikation fra trans-isomeren til den mere aktive cis-isomer. Kredit:Dusan Kolarski, University of Groningen Forsker -
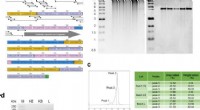 Rekombinant kollagenpolypeptid som et alsidigt knogletransplantatbiomaterialeMolekylært design og syntese af rekombinant polypeptid RCPhC1. (a) Peptidsekvensen af RCPhC1 viser Gly-Xaa-Yaa-gentagelser med aminosyresubstitutioner (rød). Alle peptidfragmenter (minimum penta-sek
Rekombinant kollagenpolypeptid som et alsidigt knogletransplantatbiomaterialeMolekylært design og syntese af rekombinant polypeptid RCPhC1. (a) Peptidsekvensen af RCPhC1 viser Gly-Xaa-Yaa-gentagelser med aminosyresubstitutioner (rød). Alle peptidfragmenter (minimum penta-sek -
 Faraday stoffer? MXene-belagt stof kan indeholde elektronisk interferens i bærbare enhederDrexel University-forskere rapporterer, at stof belagt med MXene er 99,9 % effektivt til at blokere elektromagnetisk interferens. Kredit:Drexel University Forskere ved Drexel Universitys College o
Faraday stoffer? MXene-belagt stof kan indeholde elektronisk interferens i bærbare enhederDrexel University-forskere rapporterer, at stof belagt med MXene er 99,9 % effektivt til at blokere elektromagnetisk interferens. Kredit:Drexel University Forskere ved Drexel Universitys College o -
 Blød og ionledende hydrogel kunstig tunge til astringens opfattelseÆndringer i porestørrelse på mennesketunge efterlignede hydrogel under TA-behandling. (A) SEM-billeder af human tunge efterlignet hydrogel før TA-behandling. (B) Histogram af de gennemsnitlige mikropo
Blød og ionledende hydrogel kunstig tunge til astringens opfattelseÆndringer i porestørrelse på mennesketunge efterlignede hydrogel under TA-behandling. (A) SEM-billeder af human tunge efterlignet hydrogel før TA-behandling. (B) Histogram af de gennemsnitlige mikropo
- Vandfaner på Europa:Smag på et udenjordisk hav
- Gemme det eller bruge det? Annonceringsbeslutninger midt i forbrugernes mund-til-mund
- Karakteristika for svampe
- Kunstig intelligens kan hjælpe nogle virksomheder, men fungerer muligvis ikke for andre
- Flydende krystaldråber som alsidige mikrosvømmere
- Ny forskning afslører, hvordan elefanter 'ser' verden


