Hvorfor er elektroner placeret på skallerne af et atom?
Hver elektron i et atom optager et bestemt energiniveau eller elektronskal. Skallerne er arrangeret koncentrisk omkring kernen, hvor den inderste skal er tættest på kernen og den yderste skal er længst væk. Energiniveauet stiger i takt med at afstanden fra kernen øges. Elektroner kan kun optage diskrete energiniveauer, og de tilladte energiniveauer bestemmes af de kvantetal, der er forbundet med elektronorbitaler.
Det primære kvantetal (n) bestemmer den vigtigste energiskal en elektron optager, hvor n =1 svarer til den inderste skal, n =2 til den anden skal og så videre. Vinkelmomentets kvantetal (l) bestemmer formen på elektronorbitalen inden for en given skal. Hver hovedenergiskal kan have flere underskaller med forskellige vinkelmomentum kvantetal. Det magnetiske kvantetal (ml) beskriver orienteringen af elektronorbitalen i rummet. Endelig angiver spin-kvantetallet (ms) de to mulige spin-tilstande for en elektron.
Sammenfattende er elektroner placeret på skallerne af et atom på grund af de elektrostatiske kræfter mellem elektroner og kernen. Deres fordeling er styret af kvantemekanik, hvor elektroner optager diskrete energiniveauer og orbitaler bestemt af kvantetal. Denne skalstruktur spiller en afgørende rolle i bestemmelsen af atomers og molekylers kemiske egenskaber og adfærd.
Sidste artikelEr guldstøv sammensat eller blander?
Næste artikelHvad er iste en sammensat blanding eller grundstof?
 Varme artikler
Varme artikler
-
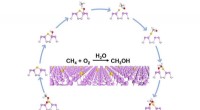 Guld-fosfor nanoplader katalyserer naturgas til grønnere energi selektivtSkematisk diagram af reaktionsvejen for methanoxidation over Au1/BP nanoark. Kredit:LUO Laihao Fremskridt inden for hydraulisk fraktureringsteknologi har gjort det muligt at opdage store reserver
Guld-fosfor nanoplader katalyserer naturgas til grønnere energi selektivtSkematisk diagram af reaktionsvejen for methanoxidation over Au1/BP nanoark. Kredit:LUO Laihao Fremskridt inden for hydraulisk fraktureringsteknologi har gjort det muligt at opdage store reserver -
 Skorpiongift til at transportere stoffer ind i hjernenKæmpe gul israelsk skorpion. Kredit:Ester Inbar Peptider- og proteinlaboratoriet ved Institut for Forskning i Biomedicin (IRB Barcelona) har udgivet en artikel i Kemisk kommunikation beskriver b
Skorpiongift til at transportere stoffer ind i hjernenKæmpe gul israelsk skorpion. Kredit:Ester Inbar Peptider- og proteinlaboratoriet ved Institut for Forskning i Biomedicin (IRB Barcelona) har udgivet en artikel i Kemisk kommunikation beskriver b -
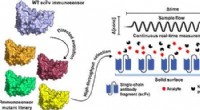 Kontinuerlig overvågning af proteiner en spilskifter for patienter med hurtigt forværrede forholdGrafisk abstrakt. Kredit:ACS, doi.org/10.1021/acssensors.0c01510 En verdens første opdagelse af forskere ved Monash University og University of Queensland kan føre til hurtigere og mere effektive
Kontinuerlig overvågning af proteiner en spilskifter for patienter med hurtigt forværrede forholdGrafisk abstrakt. Kredit:ACS, doi.org/10.1021/acssensors.0c01510 En verdens første opdagelse af forskere ved Monash University og University of Queensland kan føre til hurtigere og mere effektive -
 Søger havet, og bakteriekampe, til nye antibiotikaCameron Currie, ret, med den amerikanske energiminister Steven Chu i Microbial Sciences Building i 2012. Kredit:Jeff Miller Alexander Flemings opdagelse af penicillin - verdens første naturlige an
Søger havet, og bakteriekampe, til nye antibiotikaCameron Currie, ret, med den amerikanske energiminister Steven Chu i Microbial Sciences Building i 2012. Kredit:Jeff Miller Alexander Flemings opdagelse af penicillin - verdens første naturlige an
- Glas og energireformen:Bæredygtig produktion takket være elektricitet?
- Mørke excitoner kan yde et højt bidrag til lysemission fra nanorør
- Hvad sker der, når en stor virksomhed forsøger at overtage og omdøbe et kvarter
- Hvordan man laver en model af en Mosquito Insect Science Project
- Merkur og dets depressioner
- Hvordan virker kondensatoren i en fluorescerende lampe?


