Hvad sker der med aluminium og zinknitrat?
Når aluminiummetal tilsættes til en opløsning af zinknitrat, en redoxreaktion forekommer. Aluminium oxideres fra en neutral tilstand til en +3 oxidationstilstand, mens zink reduceres fra en +2 oxidationstilstand til en neutral tilstand. Den samlede reaktion kan repræsenteres ved følgende ligning:
```
2Al(s) + 3Zn(NO3)2(aq) → 2Al(NO3)3(aq) + 3Zn(s)
```
I denne reaktion fungerer aluminium som reduktionsmiddel og donerer elektroner til zink, som fungerer som oxidationsmiddel. Aluminiumsatomerne mister tre elektroner hver, mens zinkatomerne får to elektroner hver. Produkterne af reaktionen er aluminiumnitrat og zinkmetal.
Reaktionen mellem aluminium og zinknitrat er en meget eksoterm reaktion, hvilket betyder, at den frigiver en stor mængde varme. Den varme, der frigives ved reaktionen, kan få opløsningen til at koge og producere damp. Reaktionen kan også producere gnister eller flammer, så det er vigtigt at tage sikkerhedsforanstaltninger, når du udfører dette eksperiment.
Sikkerhedsforanstaltninger
Når du arbejder med aluminium og zinknitrat, er det vigtigt at tage følgende sikkerhedsforanstaltninger:
* Bær øjenværn og handsker.
* Arbejd i et godt ventileret område.
* Hold reaktionsblandingen væk fra åben ild eller gnister.
* Smid ikke reaktionsblandingen i håndvasken eller toilettet.
Bortskaffelse
Reaktionsblandingen skal bortskaffes i henhold til lokale regler. I de fleste tilfælde kan reaktionsblandingen bortskaffes ved at hælde den i en beholder til farligt affald.
 Varme artikler
Varme artikler
-
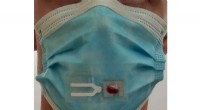 Gør masker smartere og sikrere mod COVID-19Kredit:University of California - San Diego Et nyt værktøj til overvågning af COVID-19 kan en dag være lige under næsen på dig. Forskere ved University of California San Diego er ved at udvikle en
Gør masker smartere og sikrere mod COVID-19Kredit:University of California - San Diego Et nyt værktøj til overvågning af COVID-19 kan en dag være lige under næsen på dig. Forskere ved University of California San Diego er ved at udvikle en -
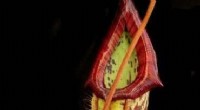 SLIPS og faldgruber:Syntetiske overflader inspireret af en kandefældefældeDen kødædende Nepenthes-fælde. Kredit:Oxford Science Blog Vores forståelse af, hvordan man manipulerer og kontrollerer væsker i teknologi, er blevet transformeret af de funktionelle overflader, de
SLIPS og faldgruber:Syntetiske overflader inspireret af en kandefældefældeDen kødædende Nepenthes-fælde. Kredit:Oxford Science Blog Vores forståelse af, hvordan man manipulerer og kontrollerer væsker i teknologi, er blevet transformeret af de funktionelle overflader, de -
 CRISPR-metode til betinget genreguleringWilfred Chen (til venstre), University of Delaware Gore professor i kemiteknik, og kandidatstuderende Ka-Hei Siu designede strukturer til målrettet genregulering i E. coli-bakterier. Kredit:University
CRISPR-metode til betinget genreguleringWilfred Chen (til venstre), University of Delaware Gore professor i kemiteknik, og kandidatstuderende Ka-Hei Siu designede strukturer til målrettet genregulering i E. coli-bakterier. Kredit:University -
 Team skaber mikrober for at omdanne affald til nyttige kemikalierForskere gensplejsede bakterier til produktion af itaconsyre, skabe dynamiske kontroller, der adskiller mikrobielle vækst- og produktionsfaser for øget effektivitet og syreudbytte. Kredit:NREL Et
Team skaber mikrober for at omdanne affald til nyttige kemikalierForskere gensplejsede bakterier til produktion af itaconsyre, skabe dynamiske kontroller, der adskiller mikrobielle vækst- og produktionsfaser for øget effektivitet og syreudbytte. Kredit:NREL Et
- Hvad er vejen for insulin fra dets produktion til at forlade cellen?
- Kontroversiel opdagelse af fodaftryk tyder på, at menneskelignende væsner kan have strejfet omkrin…
- Klimaændringer truer golfens fremtid:rapport
- Forskere bruger plantefibre til at udvikle grønne muligheder for transportindustrien
- Kæmpe isbjerg undervejs
- Forskerhold designer injicerbare nanopartikler, der frigiver naloxon, når de udløses af blåt lys


