Forskellen mellem elektrolyse og elektrokemiske celler?
Elektrolyse:
- Elektrolyse er en proces, hvor en elektrisk strøm ledes gennem et stof (normalt et smeltet salt eller en vandig opløsning) for at forårsage en kemisk ændring.
- Under elektrolyse forårsager den elektriske energi adskillelse af ioner i deres elementære komponenter.
- Elektrolyse kræver en ekstern kilde til elektrisk energi for at drive den kemiske reaktion.
- Elektrolyseprodukterne er typisk to eller flere forskellige stoffer.
Elektrokemiske celler:
- Elektrokemiske celler, også kendt som galvaniske celler eller voltaiske celler, er enheder, der omdanner kemisk energi til elektrisk energi.
- I en elektrokemisk celle sker der en spontan kemisk reaktion mellem to halvceller (oxidations- og reduktionshalvreaktioner), der genererer en elektrisk strøm.
- Elektrokemiske celler kræver ikke en ekstern strømkilde; i stedet er de afhængige af de kemiske reaktioner, der forekommer i cellen, for at producere elektricitet.
- Produkterne fra en elektrokemisk celle er elektricitet, og reaktanterne forbruges i processen.
For at opsummere bruger elektrolyse elektrisk energi til at drive kemiske ændringer, mens elektrokemiske celler omdanner kemisk energi til elektrisk energi. Elektrolyse kræver en ekstern strømkilde, hvorimod elektrokemiske celler genererer elektricitet gennem spontane kemiske reaktioner.
Sidste artikelHvad er tre kemiske ændringer, der ikke kræver levende organismer?
Næste artikelEr kaliumchlorid og sodavand det samme?
 Varme artikler
Varme artikler
-
 En videnskabelig metode til perfekt fondueKredit:American Chemical Society Ostefondue er et ikon for det schweiziske køkken og et hovedprodukt til middagsselskab. Selvom det kan virke som en simpel ret, at få den rigtige tekstur kan være
En videnskabelig metode til perfekt fondueKredit:American Chemical Society Ostefondue er et ikon for det schweiziske køkken og et hovedprodukt til middagsselskab. Selvom det kan virke som en simpel ret, at få den rigtige tekstur kan være -
 En demonstration af billeddannelse i det virkelige rum af nogle af de mest repræsentative former fo…Den skematiske model af solvatiserede protoner i enkeltlagsvand. Blå:solvatiserede protoner af Zundel-typen; Rød:vandmolekyler; Gul:guld substrat. Kredit:Ying Jiang, Peking University Et team af fo
En demonstration af billeddannelse i det virkelige rum af nogle af de mest repræsentative former fo…Den skematiske model af solvatiserede protoner i enkeltlagsvand. Blå:solvatiserede protoner af Zundel-typen; Rød:vandmolekyler; Gul:guld substrat. Kredit:Ying Jiang, Peking University Et team af fo -
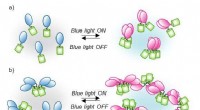 Proteinblanding under blåt lysSkema af CRY2PHR klyngemekanismen udløst af blåt lys. I dette optogenetiske system, CRY2-klynger (blå og pink) styres reversibelt af blåt lys. Hvis CRY2 er forbundet med fluorescerende proteiner (grøn
Proteinblanding under blåt lysSkema af CRY2PHR klyngemekanismen udløst af blåt lys. I dette optogenetiske system, CRY2-klynger (blå og pink) styres reversibelt af blåt lys. Hvis CRY2 er forbundet med fluorescerende proteiner (grøn -
 Ny genanvendelig hydrogel kunne høste rent, afsaltet vand fra fugtig luft over havoverfladerDen nye hydrogel udviklet af et team fra National University of Singapore, ledet af adjunkt Tan Swee Ching (yderst til højre), kan bruges til at høste rent vand fra fugtig luft over havoverflader, blo
Ny genanvendelig hydrogel kunne høste rent, afsaltet vand fra fugtig luft over havoverfladerDen nye hydrogel udviklet af et team fra National University of Singapore, ledet af adjunkt Tan Swee Ching (yderst til højre), kan bruges til at høste rent vand fra fugtig luft over havoverflader, blo
- Hvorfor er det, at HCL-gas ikke kan opsamles over vand?
- Hvordan afhænger et objekts opdrift af tætheden?
- Hvordan brænder kul, hvis det er en sten?
- Forskere hævder, at data fra Planck rumobservatorium antyder, at universet er en kugle
- Forskere bruger kunstigt neuralt netværk til at simulere et kvante-system med mange legemer
- Ny teori illustrerer udviklingen af universet kan være anderledes, end vi troede


