Er en neutral opløsning stærk elektrolyt?
Stærke elektrolytter er stoffer, der fuldstændigt dissocierer til ioner, når de opløses i vand. Det betyder, at alle forbindelsens molekyler bryder sammen i deres bestanddele, hvilket resulterer i en høj koncentration af ioner i opløsningen. Stærke elektrolytter omfatter typisk ioniske forbindelser såsom natriumchlorid (NaCl), kaliumhydroxid (KOH) og svovlsyre (H2SO4).
På den anden side er en neutral opløsning en, hvor koncentrationen af hydrogenioner (H+) og hydroxidioner (OH-) er ens, hvilket resulterer i en pH-værdi på 7. Neutrale opløsninger kan dannes ved at opløse visse typer forbindelser, såsom vand selv, eller ved at blande en syre og en base i passende forhold.
Mens nogle stærke elektrolytter kan producere neutrale opløsninger, når de opløses i vand (såsom natriumchlorid, som danner en neutral opløsning med en pH-værdi på 7), er ikke alle neutrale opløsninger dannet af stærke elektrolytter. For eksempel er rent vand en neutral opløsning, men det indeholder ingen stærke elektrolytter. I stedet skyldes vands neutrale pH ligevægten mellem dissocieringen af vandmolekyler i H+ og OH- ioner og rekombinationen af disse ioner tilbage til vandmolekyler.
Derfor indikerer tilstedeværelsen af en neutral opløsning ikke nødvendigvis tilstedeværelsen af en stærk elektrolyt. Identiteten og koncentrationen af det opløste stof bestemmer opløsningens elektrolytstyrke og dens pH-værdi.
Sidste artikelEr H2CrO4 en elektrolyt eller en ikke-elektrolyt?
Næste artikelHvad betyder opløsningsmiddelrens?
 Varme artikler
Varme artikler
-
 En enklere model kommer til sagen med proteinerCecilia Clementi. Kredit:Jeff Fitlow/Rice University Beregningsmodeller er kommet langt i deres evne til at simulere de mest basale biologiske processer, såsom hvordan proteiner folder. En ny tekn
En enklere model kommer til sagen med proteinerCecilia Clementi. Kredit:Jeff Fitlow/Rice University Beregningsmodeller er kommet langt i deres evne til at simulere de mest basale biologiske processer, såsom hvordan proteiner folder. En ny tekn -
 Birnessite -undersøgelse giver indsigt i elektrokemi, energilagringKredit:CC0 Public Domain Adsorptionen af ioner fra elektrolytten ved en elektrodeoverflade er en allestedsnærværende proces, brug for både eksisterende og nye elektrokemiske energiteknologier. M
Birnessite -undersøgelse giver indsigt i elektrokemi, energilagringKredit:CC0 Public Domain Adsorptionen af ioner fra elektrolytten ved en elektrodeoverflade er en allestedsnærværende proces, brug for både eksisterende og nye elektrokemiske energiteknologier. M -
 Gør stabile molekyler reaktive med lysBo Durbeej, professor i beregningsfysik ved Linköpings Universitet. Kredit:Thor Balkhed/Linköpings Universitet Forskere ved Linköpings Universitet har brugt computersimuleringer til at vise, at sta
Gør stabile molekyler reaktive med lysBo Durbeej, professor i beregningsfysik ved Linköpings Universitet. Kredit:Thor Balkhed/Linköpings Universitet Forskere ved Linköpings Universitet har brugt computersimuleringer til at vise, at sta -
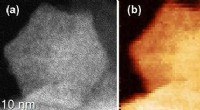 Mangan kan endelig løse problem med brintbrændstofcellerBilledet til venstre viser mangankatalysatorpartikelform. De rigtige billeder viser den ensartede elementære fordeling af kulstof gennem partiklen. Kredit:Gang Wu, Universitetet i Buffalo. Mangan
Mangan kan endelig løse problem med brintbrændstofcellerBilledet til venstre viser mangankatalysatorpartikelform. De rigtige billeder viser den ensartede elementære fordeling af kulstof gennem partiklen. Kredit:Gang Wu, Universitetet i Buffalo. Mangan
- Ny undersøgelse undersøger årsagerne og konsekvenserne af Wimberley -oversvømmelserne i 2015
- Økonomer forsker i, hvordan man bedst fordeler tid mellem kreative og rutinemæssige opgaver
- Globalt luftfartsselskab advarer mod protektionisme, stigende omkostninger
- Kan vulkanske superudbrud føre til større afkøling? Undersøgelse tyder på nej
- Informationstransport i antiferromagneter via pseudospin-magnoner
- Indsigt gennem atomsimulering


