Hvorfor opfører borforbindelser sig som Lewis-syrer?
1. Tøm orbital: Bor har en tom p-orbital i sin valensskal, som kan acceptere et par elektroner. Denne tomme orbital gør bor til en potentiel elektronparacceptor, som er karakteristisk for en Lewis-syre.
2. Høj elektronegativitet: Bor har en relativt høj elektronegativitet (2,04 på Pauling-skalaen). Det betyder, at det har en stærk tiltrækning af elektroner, hvilket gør det muligt for den at trække elektrontæthed fra naboatomer eller molekyler. Denne elektron-tilbagetrækningsevne bidrager til den Lewis sure karakter af borforbindelser.
3. Oprettelse af koordinatbindinger: Borforbindelser kan danne koordinerede kovalente bindinger ved at acceptere elektronpar fra Lewis-baser. I disse koordinatbindinger fungerer boratomet som elektronparacceptor, og Lewis-basen donerer elektronparret. Denne elektronpar-accepterende evne er et definerende træk ved Lewis-syrer.
4. Reaktivitet med Lewis-baser: Borforbindelser reagerer let med Lewis-baser for at danne stabile komplekser. Disse komplekser dannes ved donation af elektronpar fra Lewis-basen til den tomme p-orbital af bor. Stabiliteten af disse komplekser opstår fra de stærke elektrostatiske interaktioner mellem det positivt ladede boratom og de negativt ladede ensomme par på Lewis-basen.
5. Polaritet af obligationer: Bindingerne mellem bor og mere elektronegative elementer, såsom fluor, oxygen og nitrogen, er polære. Denne polaritet resulterer i en delvis positiv ladning på boratomet, hvilket gør det mere modtageligt for nukleofilt angreb fra Lewis-baser.
Samlet set bidrager kombinationen af en tom p-orbital, høj elektronegativitet, evne til at danne koordinatbindinger, reaktivitet med Lewis-baser og polariteten af bindinger til Lewis-syreopførsel af borforbindelser.
Sidste artikelHvad er 5 almindelige anvendelser for bor?
Næste artikelHvad sker der, når boret absorberes?
 Varme artikler
Varme artikler
-
 Åndeprøver kan snuse til COVID-19Et transmissionselektronmikrograf af SARS-CoV-2-viruspartikler (UK B.1.1.7-variant), isoleret fra en patientprøve og dyrket i cellekultur. Kredit:NIAID Siden maj 2021 har chauffører, der krydser S
Åndeprøver kan snuse til COVID-19Et transmissionselektronmikrograf af SARS-CoV-2-viruspartikler (UK B.1.1.7-variant), isoleret fra en patientprøve og dyrket i cellekultur. Kredit:NIAID Siden maj 2021 har chauffører, der krydser S -
 Papirbaseret tuberkulosetest kan øge diagnoser i udviklingslandeDette mikrofotografi afslører Mycobacterium tuberculosis-bakterier ved hjælp af syrefast Ziehl-Neelsen-farve; Forstørret 1000 X. De syrefaste pletter afhænger af mykobakteriers evne til at tilbagehold
Papirbaseret tuberkulosetest kan øge diagnoser i udviklingslandeDette mikrofotografi afslører Mycobacterium tuberculosis-bakterier ved hjælp af syrefast Ziehl-Neelsen-farve; Forstørret 1000 X. De syrefaste pletter afhænger af mykobakteriers evne til at tilbagehold -
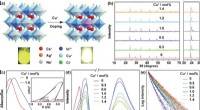 Cu+-doping øger selvfanget exciton-emission i legeret Cs2(Ag/Na)InCl6-dobbeltperovskita) Krystalstruktur af Cs2 (Ag/Na)InCl6 og det krystallografiske sted for Cu+ dopingmidler. PL-fotografierne (λex = 365 nm) for Cs2 (Ag/Na)InCl6 og Cs2 (Ag/Na)InCl6 :1,0 %Cu+ pulvere præsenteres, som v
Cu+-doping øger selvfanget exciton-emission i legeret Cs2(Ag/Na)InCl6-dobbeltperovskita) Krystalstruktur af Cs2 (Ag/Na)InCl6 og det krystallografiske sted for Cu+ dopingmidler. PL-fotografierne (λex = 365 nm) for Cs2 (Ag/Na)InCl6 og Cs2 (Ag/Na)InCl6 :1,0 %Cu+ pulvere præsenteres, som v -
 3-D print med applikationer i den farmaceutiske industriKredit:CC0 Public Domain University of Sevilla forskere, i samarbejde med University of Nottingham, har formået at skabe det første billede af nanopartikler af stabiliseret guld med biologisk nedb
3-D print med applikationer i den farmaceutiske industriKredit:CC0 Public Domain University of Sevilla forskere, i samarbejde med University of Nottingham, har formået at skabe det første billede af nanopartikler af stabiliseret guld med biologisk nedb
- Seneste talte i hjulet driver hjernekortlægningsfremskridt
- Hvorfor bruger planter cotransportere i stedet for ionkanaler til at overføre anioner til celler?
- 14Kt Gold Vs. 18Kt Gold
- Amazons hovedkvarter:Lignende grundlæggende men forskellige vibes
- Forståelse af, hvordan bakkeskråninger forbinder økosystemer
- Sjove eksperimenter for det periodiske bord


