Er SCl2-molekylet polært eller upolært?
Svovls elektronegativitet er 2,58, mens chlors elektronegativitet er 3,0. Det betyder, at kloratomer har en højere elektronegativitet end svovl. Som følge heraf trækkes elektronerne i S-Cl-bindingerne mere mod chloratomerne, hvilket skaber en delvis negativ ladning på chloratomerne og en delvis positiv ladning på svovlatomet.
Forskellen i elektronegativitet mellem svovl og klor er 0,42 (3,0 - 2,58). Denne værdi er signifikant nok til at skabe en polær binding. Men da molekylet har en lineær form, ophæver de to polære S-Cl-bindinger hinanden, hvilket resulterer i et upolært molekyle.
Derfor er SCl2 et ikke-polært molekyle.
 Varme artikler
Varme artikler
-
 Eksperimentelle tests af relativistisk kemi vil opdatere det periodiske systemFig.1 Kort oversigt over nærværende undersøgelse. Kredit:Osaka University Alle kemistuderende undervises i det periodiske system, en organisation af de elementer, der hjælper dig med at identifice
Eksperimentelle tests af relativistisk kemi vil opdatere det periodiske systemFig.1 Kort oversigt over nærværende undersøgelse. Kredit:Osaka University Alle kemistuderende undervises i det periodiske system, en organisation af de elementer, der hjælper dig med at identifice -
 Biochar kan øge kulstoflageret, men fordele for spiring og vækst synes knappeIllinois Sustainable Technology Center forskere Elizabeth Meschewski, venstre, og Nancy Holm og samarbejdspartnere udviklede en systematisk undersøgelse for at teste effektiviteten af jordadditiv bi
Biochar kan øge kulstoflageret, men fordele for spiring og vækst synes knappeIllinois Sustainable Technology Center forskere Elizabeth Meschewski, venstre, og Nancy Holm og samarbejdspartnere udviklede en systematisk undersøgelse for at teste effektiviteten af jordadditiv bi -
 Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator
Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator -
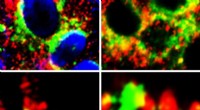 Undersøgelse afslører potentielt nyt behandlingsmål i kampen mod COVID-19Celler, der viser tæt nærhed (gul) af GRP78 (grøn) med Spike-protein af SARS-Cov-2 (rød) (venstre paneler) og ACE2 (rød) (højre paneler). Kredit:Hovedforfatter Anthony Carlos, PhD Den hurtige udvi
Undersøgelse afslører potentielt nyt behandlingsmål i kampen mod COVID-19Celler, der viser tæt nærhed (gul) af GRP78 (grøn) med Spike-protein af SARS-Cov-2 (rød) (venstre paneler) og ACE2 (rød) (højre paneler). Kredit:Hovedforfatter Anthony Carlos, PhD Den hurtige udvi
- Tutorial of How to Calculate Altitude & Temperature
- Glitrende strande:Cypern har det reneste vand i EU
- Undersøgelse viser potentiale for jordvenlig plasterstatning
- Nyhedsmedier bliver ved med at trykke på mute-knappen på kvindesport
- Placering af appelsinskalolie til nye, behagelige aromaforbindelser
- I en varmere verden er halvdelen af alle arter på vej. Hvor skal de hen?


