Hvorfor er hydrogenioner plus, når det er H2O?
Årsagen til tilstedeværelsen af både H+ og OH- ioner i rent vand ligger i vandmolekylets polaritet. På grund af forskellen i elektronegativitet mellem ilt og brint, tiltrækker iltatomet en smule elektroner mod sig selv, hvilket skaber en svag negativ ladning på iltenden og en svag positiv ladning på hydrogenenden af molekylet. Dette tillader andre vandmolekyler at interagere med disse delvist ladede områder, hvilket fører til lejlighedsvis overførsel af hydrogenioner (protoner) fra et vandmolekyle til et andet.
Mens koncentrationen af disse ioner i rent vand er meget lav (ca. 1 x 10^-7 mol pr. liter), er det denne balance mellem H+ og OH-ioner, der bestemmer vands pH og dets sure eller basiske natur. Afvigelser fra denne balance, hvor koncentrationen af H+ ioner stiger eller falder, resulterer i henholdsvis sure eller basiske opløsninger.
Sidste artikelHvad er nogle kemiske forvitringsprocesser?
Næste artikelNår du blander blå og gul, hvad laver det?
 Varme artikler
Varme artikler
-
 Skaller og grapefrugter inspirerer til først fremstillet ikke-skærbart materialeKredit:CC0 Public Domain Ingeniører har hentet deres inspiration fra skaller og grapefrugter til at skabe, hvad de siger er det første fremstillede ikke-skærbare materiale. Dette nye materiale, s
Skaller og grapefrugter inspirerer til først fremstillet ikke-skærbart materialeKredit:CC0 Public Domain Ingeniører har hentet deres inspiration fra skaller og grapefrugter til at skabe, hvad de siger er det første fremstillede ikke-skærbare materiale. Dette nye materiale, s -
 Kombinatorisk high-throughput-strategi foreslået til screening af hydrogenudviklingsreaktionskataly…Skematisk illustration af high-throughput boble screeningsmetode. Kredit:NIMTE En forskergruppe ledet af prof. Wang Junqiang ved Ningbo Institute of Materials Technology and Engineering (NIMTE) und
Kombinatorisk high-throughput-strategi foreslået til screening af hydrogenudviklingsreaktionskataly…Skematisk illustration af high-throughput boble screeningsmetode. Kredit:NIMTE En forskergruppe ledet af prof. Wang Junqiang ved Ningbo Institute of Materials Technology and Engineering (NIMTE) und -
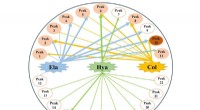 Potentielle anti-aldringskomponenter af Moringa oleifera bladNetværksdiagram over multikomponent- og multi-target-interaktioner af Moringa oleifera-blade. Kredit:WBG Moringa oleifera Lam., også kendt som Miracle Tree, primært afledt fra Indien, er nu vidt ud
Potentielle anti-aldringskomponenter af Moringa oleifera bladNetværksdiagram over multikomponent- og multi-target-interaktioner af Moringa oleifera-blade. Kredit:WBG Moringa oleifera Lam., også kendt som Miracle Tree, primært afledt fra Indien, er nu vidt ud -
 Vi komposterede bionedbrydelige balloner. Her er hvad vi fandt efter 16 ugerBionedbrydelige balloner efter 16 uger i ferskvand. Kredit:Jesse Benjamin, Forfatter angivet Efter 16 uger i en industriel kompostbunke, vi udgravede blå og hvide balloner og fandt dem helt uskadt
Vi komposterede bionedbrydelige balloner. Her er hvad vi fandt efter 16 ugerBionedbrydelige balloner efter 16 uger i ferskvand. Kredit:Jesse Benjamin, Forfatter angivet Efter 16 uger i en industriel kompostbunke, vi udgravede blå og hvide balloner og fandt dem helt uskadt
- Astronomer observerer opvågningen af en Be/røntgen-binær
- Hvad forårsagede den største afstemningsfejl i 40 år i Trump-Biden-løbet?
- Nyt ultra-miniaturiseret skop, mindre invasivt, producerer billeder i højere kvalitet
- Livestreaming af kriminalitet – hvordan vil Facebook Live og Periscope udfordre amerikansk privatliv…
- Hvordan den oprindelige folks praksis med god ild kan hjælpe vores skove til at trives
- AI kan lære matematiklærere, hvordan man forbedrer elevernes færdigheder


