Hvorfor Et atom af lithium (Li) danner en ionbinding med klor (Cl) for at danne chlorid. Hvordan er valenselektronerne disse atomer omarrangeret denne binding?
Når lithium (Li) og chlor (Cl) atomer interagerer for at danne en ionbinding, gennemgår deres valenselektroner en omlejring for at opnå en stabil elektronkonfiguration. Sådan sker det:
1. Indledende elektronkonfigurationer:
- Lithium (Li):1s²2s¹ (3 valenselektroner)
- Klor (Cl):1s²2s²2p⁶3s²3p⁵ (7 valenselektroner)
2. Elektronoverførsel:
- Lithium overfører sin ene valenselektron til klor.
- Klor accepterer denne elektron og bliver negativt ladet.
- Som følge heraf mister lithium en elektron og bliver positivt ladet, mens klor får en elektron og bliver negativt ladet.
3. Danning af ioner:
- Lithiumatomet mister sin eneste valenselektron, hvilket resulterer i en positivt ladet lithiumion (Li⁺) med en 1s² elektronkonfiguration.
- Kloratom får en ekstra elektron, hvilket resulterer i en negativt ladet chloridion (Cl⁻) med en 1s²2s²2p⁶3s²3p⁶ elektronkonfiguration.
4. Ionisk bindingsdannelse:
- Den elektrostatiske tiltrækning mellem den positivt ladede lithiumion (Li⁺) og den negativt ladede chloridion (Cl⁻) holder dem sammen og danner en ionbinding.
Sammenfattende involverer dannelsen af en ionbinding mellem lithium og chlor overførsel af en valenselektron fra lithium til chlor, hvilket resulterer i dannelsen af positivt ladede lithiumioner (Li⁺) og negativt ladede chloridioner (Cl⁻). Disse ioner holdes derefter sammen af de stærke elektrostatiske tiltrækningskræfter mellem modsatte ladninger og danner den ioniske forbindelse lithiumchlorid (LiCl).
 Varme artikler
Varme artikler
-
 Stiller ind på morgendagens LCD-skærme:Udforsk den nye IGZO-11-halvlederKredit:CC0 Public Domain I 1985, Noboru Kimizuka fra det nationale institut for forskning i uorganiske materialer, Japan havde banebrydende ideen om polykrystallinsk indium-gallium-zinkoxid (IGZO)
Stiller ind på morgendagens LCD-skærme:Udforsk den nye IGZO-11-halvlederKredit:CC0 Public Domain I 1985, Noboru Kimizuka fra det nationale institut for forskning i uorganiske materialer, Japan havde banebrydende ideen om polykrystallinsk indium-gallium-zinkoxid (IGZO) -
 blodig, freaky, cool:Marine sneglegift kunne forbedre insulin til diabetespatienterEn keglesnegl venter på, at en fisk svømmer forbi. Kredit:University of Utah Health Selvom den er moderat mobil, marine keglesnegle har perfektioneret flere strategier til at fange bytte. Nogle fi
blodig, freaky, cool:Marine sneglegift kunne forbedre insulin til diabetespatienterEn keglesnegl venter på, at en fisk svømmer forbi. Kredit:University of Utah Health Selvom den er moderat mobil, marine keglesnegle har perfektioneret flere strategier til at fange bytte. Nogle fi -
 Spraytørring – perfekt dosering takket være lægemiddelkapslerKerne-skal partikel. Kredit:Fraunhofer IGB Instant kaffe og mælkepulver fremstilles ved spraytørring. Fraunhofer-forskere har tilpasset denne teknik til det vanskelige spørgsmål om at inkorporere
Spraytørring – perfekt dosering takket være lægemiddelkapslerKerne-skal partikel. Kredit:Fraunhofer IGB Instant kaffe og mælkepulver fremstilles ved spraytørring. Fraunhofer-forskere har tilpasset denne teknik til det vanskelige spørgsmål om at inkorporere -
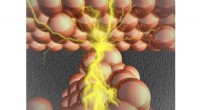 Bygge bro mellem nanoskalaen:Et dybt kig inde i atomkontakterBroen, der dannes i metalsulfidlaget, forbinder to metalelektroder, resulterer i, at atomkontakten tændes. Kredit:Manabu Kiguchi Et team af forskere fra Tokyo Institute of Technology har opnået hi
Bygge bro mellem nanoskalaen:Et dybt kig inde i atomkontakterBroen, der dannes i metalsulfidlaget, forbinder to metalelektroder, resulterer i, at atomkontakten tændes. Kredit:Manabu Kiguchi Et team af forskere fra Tokyo Institute of Technology har opnået hi
- Hvad er oktan og hvordan virker det?
- Risiko i forsyningskæder er forskellig efter branche, ny rapport finder
- Hvad er molekylformlen for chrom?
- Mennesker er ikke ude af krogen for udryddelse af store planteædere - dengang eller nu
- Sådan finder du en Ellipse
- Hvad er falsk honning, og hvorfor fandt de officielle test det ikke op?


