Hvad fortæller vsepr-teorien os om et molekyle?
1. Molekylær geometri:VSEPR-teori forudsiger det tredimensionelle arrangement af atomer i et molekyle ved at overveje de frastødende kræfter mellem elektronpar. Det bestemmer den molekylære geometri, såsom lineær, trigonal plan, tetraedrisk, oktaedrisk osv., baseret på elektronpararrangementet omkring det centrale atom.
2. Elektronparrepulsioner:Den grundlæggende forudsætning for VSEPR-teorien er, at elektronparrene i et molekyle har en tendens til at frastøde hinanden. Denne frastødning påvirker den molekylære geometri, da elektronpar forsøger at holde sig så langt væk fra hinanden som muligt.
3. Sterisk tal:Det steriske tal for et centralt atom i et molekyle refererer til det samlede antal elektronpar, der omgiver det, inklusive både bindingspar og ensomme par. Det steriske tal bestemmer elektronpargeometrien omkring det centrale atom.
4. Elektronpargeometri:Elektronpargeometri beskriver det rumlige arrangement af elektronpar omkring et centralt atom, uanset om de er bindende eller ensomme par. VSEPR-teori forudsiger elektronpargeometrier såsom oktaedriske, tetraedriske, trigonale pyramideformede, bøjede osv.
5. Forudsigelse af bindingsvinkel:Ved at overveje elektronpargeometrien og det steriske tal, kan VSEPR-teorien forudsige bindingsvinklerne mellem atomer i et molekyle. De optimale bindingsvinkler er resultatet af at minimere elektronparrepulsion.
6. Molekylær form:Den molekylære form er den overordnede tredimensionelle struktur af molekylet under hensyntagen til både elektronpargeometrien og atomernes positioner. VSEPR teori giver information om det rumlige arrangement af atomer og deres bindinger, hvilket giver os mulighed for at visualisere den molekylære form.
7. Polaritet:VSEPR-teori hjælper med at bestemme den molekylære polaritet baseret på arrangementet af polære bindinger og tilstedeværelsen af enlige par. Den forudsiger, om et molekyle er polært eller upolært.
Ved at forstå principperne for VSEPR-teori kan kemikere forudsige den molekylære geometri, elektronparrangement, bindingsvinkler og overordnede form af et molekyle baseret på antallet og typen af valenselektronpar, der er til stede i molekylet.
Sidste artikelHvad er elektronprikstrukturen dannet mellem calcium og klor?
Næste artikelHvad er pH-værdien af forstærket vaskemiddel?
 Varme artikler
Varme artikler
-
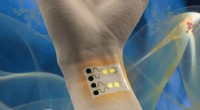 En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til
En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til -
 Transformering af kuldioxid – forskere udvikler ny to-trins CO2-konverteringsteknologiUD Professor Feng Jiaos team konstruerede en elektrolysator, afbilledet her, at gennemføre deres nye to-trins konverteringsproces. Kredit:Feng Jiao Et team af forskere ved University of Delawares
Transformering af kuldioxid – forskere udvikler ny to-trins CO2-konverteringsteknologiUD Professor Feng Jiaos team konstruerede en elektrolysator, afbilledet her, at gennemføre deres nye to-trins konverteringsproces. Kredit:Feng Jiao Et team af forskere ved University of Delawares -
 COVID-19 testmetode giver resultater inden for et sekundSkematisk og fotografi af COVID-19 sensorstrimmel og printkortet fremstillet til at producere en digital sensoroutput. Kredit:Minghan Xian, Hao Luo, Xinyi Xia, Chaker Fares, Patrick H. Carey IV, Chan-
COVID-19 testmetode giver resultater inden for et sekundSkematisk og fotografi af COVID-19 sensorstrimmel og printkortet fremstillet til at producere en digital sensoroutput. Kredit:Minghan Xian, Hao Luo, Xinyi Xia, Chaker Fares, Patrick H. Carey IV, Chan- -
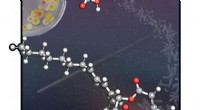 En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide
En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide


