I saltsyre (HCl) har klor større elektronegativitet end brint. Derfor?
 Varme artikler
Varme artikler
-
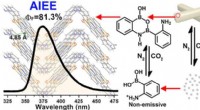 Nyt aggregationsinduceret aromatisk molekyle med forbedret emission opdaget2-APBA-dimeren, der har tendens til at aggregere til en meget ordnet struktur, er AIEE-aktiv. Kredit:LI Xiaopei Aggregations-inducerede molekyler med øget emission (AIEE), nye selvlysende material
Nyt aggregationsinduceret aromatisk molekyle med forbedret emission opdaget2-APBA-dimeren, der har tendens til at aggregere til en meget ordnet struktur, er AIEE-aktiv. Kredit:LI Xiaopei Aggregations-inducerede molekyler med øget emission (AIEE), nye selvlysende material -
 Ny teknik muliggør 3D-print med pasta af silikonepartikler i vandNy teknik udgivet i Avancerede materialer viser processen med 3-D-print af silikonegummi. Kredit:Orlin Velev, NC State University Ved at bruge principperne bag dannelsen af sandslotte fra vådt
Ny teknik muliggør 3D-print med pasta af silikonepartikler i vandNy teknik udgivet i Avancerede materialer viser processen med 3-D-print af silikonegummi. Kredit:Orlin Velev, NC State University Ved at bruge principperne bag dannelsen af sandslotte fra vådt -
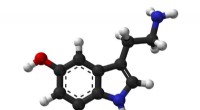 Forskerhold udvikler et nyt system til at spore hjernekemikalierBall-and-stick-model af serotonin-molekylet. Kredit:Public Domain Forskere ved UCLA og Columbia University har udviklet en ny metode til at spore aktiviteten af små molekyler i hjernen, herunder
Forskerhold udvikler et nyt system til at spore hjernekemikalierBall-and-stick-model af serotonin-molekylet. Kredit:Public Domain Forskere ved UCLA og Columbia University har udviklet en ny metode til at spore aktiviteten af små molekyler i hjernen, herunder -
 Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale.
Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale.
- En nemmere måde at spise grønt på:Vitamin B12 kan produceres under dejgæring
- Bevarelse af stjernerne:Lysforurening og hvad du kan gøre ved det
- Bydrab stiger i klynger, selv når byer bliver mere sikre
- Kinas Huawei optrapper charmeoffensiven, afviser sikkerhedsangst
- E-scootere er ved at blive vildt populære, men vi skal tage vejret i betragtning
- College store valg kan forudsige kønske lønforskelle


