I en ionisk forbindelse er tiltrækningen mellem kationer og fastholdelse af forbindelser sværere?
For eksempel i natriumchlorid (NaCl) har natriumionerne en ladning på +1, og chloridionerne har en ladning på -1. Afstanden mellem ionerne er forholdsvis lille, så tiltrækningen mellem dem er stærk. Denne stærke tiltrækning holder NaCl-forbindelsen sammen og gør den til et fast stof ved stuetemperatur.
I modsætning hertil har kaliumionerne i kaliumiodid (KI) en ladning på +1, og iodidionerne har en ladning på -1. Afstanden mellem ionerne i KI er dog større end afstanden mellem ionerne i NaCl. Det betyder, at tiltrækningen mellem ionerne i KI er svagere end tiltrækningen mellem ionerne i NaCl. Som et resultat er KI en væske ved stuetemperatur.
Derfor holder attraktionerne mellem kationer og anioner ioniske forbindelser sammen. Styrken af disse attraktioner afhænger af ladningerne af ionerne og afstanden mellem dem. Jo større ladninger ionerne er og jo mindre afstanden er mellem dem, jo stærkere tiltrækning og jo tættere holdes forbindelsen sammen.
Sidste artikelHvad skal renses ved at koge og kondensere?
Næste artikelHvilke partikler dannes ved ionbinding?
 Varme artikler
Varme artikler
-
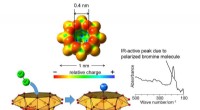 Polarisering af brommolekyle i vanadiumoxidklyngehulrum og ny alkanbromeringSpektrets top på grund af polariseret brommolekyle. Kredit:Kanazawa University Alkaner er hovedbestanddelene i naturgas og olie, kun bestående af kulstof- og brintatomer. CH-bindingerne af alkaner
Polarisering af brommolekyle i vanadiumoxidklyngehulrum og ny alkanbromeringSpektrets top på grund af polariseret brommolekyle. Kredit:Kanazawa University Alkaner er hovedbestanddelene i naturgas og olie, kun bestående af kulstof- og brintatomer. CH-bindingerne af alkaner -
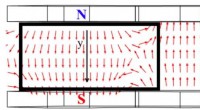 Magnetfelters indflydelse på tyndfilmstrukturerVisualisering af et magnetfelt mellem permanente magneter ved placeringen af substratet til aflejring af NiFe/IrMn film tyndfilmstruktur. Kredit:Valeria Rodionova Et team af forskere fra Immanue
Magnetfelters indflydelse på tyndfilmstrukturerVisualisering af et magnetfelt mellem permanente magneter ved placeringen af substratet til aflejring af NiFe/IrMn film tyndfilmstruktur. Kredit:Valeria Rodionova Et team af forskere fra Immanue -
 Polymerbelægning accelererer brændstofproduktionenForskere fra University of Tsukuba og Osaka University finder, at en polymerbelægning effektivt kan transportere CO2-molekyler til en metalkatalysator, dermed accelerere sin produktdannelse og tilbyde
Polymerbelægning accelererer brændstofproduktionenForskere fra University of Tsukuba og Osaka University finder, at en polymerbelægning effektivt kan transportere CO2-molekyler til en metalkatalysator, dermed accelerere sin produktdannelse og tilbyde -
 Biodiesel lavet af kasserede papkasserKonceptuelt diagram til fremstilling af biobrændstoffer ved hjælp af mikroorganismer som råmateriale til træbaseret biomasse. Kredit:Korea Institute of Science and Technology (KIST) Biludstødning
Biodiesel lavet af kasserede papkasserKonceptuelt diagram til fremstilling af biobrændstoffer ved hjælp af mikroorganismer som råmateriale til træbaseret biomasse. Kredit:Korea Institute of Science and Technology (KIST) Biludstødning
- Hvordan tilfører perfluoroctylbromid ilt til væv?
- Hvilken ionisk forbindelse af K2O?
- Det første eksperiment af sin slags bruger diamantambolte til at simulere Jordens kerne
- Bekymringer om at sprede jordmikrober bør ikke forsinke søgen efter liv på Mars
- Forskere udvikler MRSA-dræbende maling
- Hvordan ligner ionbindinger og van der waals-kræfter hinanden?


