Hvordan kan et molekyle have en meget stærk molekylær dipol?
Overvej for eksempel molekylet hydrogenchlorid (HCl). Klor er mere elektronegativt end brint, så elektronerne i den kovalente binding trækkes mere mod kloratomet. Dette skaber en delvis negativ ladning på kloratomet og en delvis positiv ladning på hydrogenatomet. Den resulterende molekylære dipol er ret stærk, hvilket giver HCl en polær karakter.
Et andet eksempel er vandmolekylet (H2O). Ilt er mere elektronegativt end brint, så elektronerne i O-H-bindingerne trækkes mere mod oxygenatomet. Dette skaber en delvis negativ ladning på oxygenatomet og delvis positiv ladning på hydrogenatomerne. Arrangementet af disse partielle ladninger resulterer i en bøjet molekylær struktur og en stærk molekylær dipol, hvilket gør vand til et polært molekyle.
Styrken af den molekylære dipol kan påvirke forskellige egenskaber af molekylet, såsom dets opløselighed, kogepunkt og reaktivitet. Molekyler med stærke dipoler har en tendens til at være mere opløselige i polære opløsningsmidler og har højere kogepunkter på grund af stærkere intermolekylære kræfter. Derudover kan tilstedeværelsen af en stærk molekylær dipol påvirke molekylets kemiske reaktivitet, da det kan påvirke tiltrækningen eller frastødningen mellem molekylet og andre molekyler eller ioner.
Sidste artikelHvorfor leder molekylære forbindelser ikke elektricitet?
Næste artikelHvad er opløseligheden af olieeddikesyre?
 Varme artikler
Varme artikler
-
 Forskere opdager nye strukturer i den mindste isterningForskere opdagede nye strukturer i den mindste isterning. Kredit:Li Gang og Li Qinming Nedfrysning af vand er en af de mest almindelige processer. Imidlertid, Det har været en udfordring at fors
Forskere opdager nye strukturer i den mindste isterningForskere opdagede nye strukturer i den mindste isterning. Kredit:Li Gang og Li Qinming Nedfrysning af vand er en af de mest almindelige processer. Imidlertid, Det har været en udfordring at fors -
 DNA er kun et blandt millioner af mulige genetiske molekylerKredit:CC0 Public Domain Biologi koder information i DNA og RNA, som er komplekse molekyler finjusteret til deres funktioner. Men er de den eneste måde at gemme arvelig molekylær information? Nogl
DNA er kun et blandt millioner af mulige genetiske molekylerKredit:CC0 Public Domain Biologi koder information i DNA og RNA, som er komplekse molekyler finjusteret til deres funktioner. Men er de den eneste måde at gemme arvelig molekylær information? Nogl -
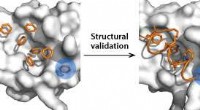 Benzen-baserede prober fremhæver to skjulte bindingssteder på et anticancer-lægemiddelmålBindingslommedetektion ved hjælp af benzenmolekyler som prober (venstre) og strukturel validering ved brug af hæftede peptider (højre). Kredit:Y. S. Tan et al. I jagten på nye kræftbehandlinger, A
Benzen-baserede prober fremhæver to skjulte bindingssteder på et anticancer-lægemiddelmålBindingslommedetektion ved hjælp af benzenmolekyler som prober (venstre) og strukturel validering ved brug af hæftede peptider (højre). Kredit:Y. S. Tan et al. I jagten på nye kræftbehandlinger, A -
 Forskere bruger fotoner til at adskille metalionerKandidatstuderende Yan Zhou (til venstre) og postdoc-forsker Sahan Salpage bruger lys til at adskille metalioner. denne proces, videnskabsmænd mener, vil være billigere og grønnere end eksisterende me
Forskere bruger fotoner til at adskille metalionerKandidatstuderende Yan Zhou (til venstre) og postdoc-forsker Sahan Salpage bruger lys til at adskille metalioner. denne proces, videnskabsmænd mener, vil være billigere og grønnere end eksisterende me
- Venner, kan lide, falske følgere og kontanter - internetpåvirkere under mikroskopet
- Hestekræfter, bogstaveligt talt:Finsk hesteshow kører på gødning
- Har Kepler fundet ideelle SETI-målplaneter?
- Hvordan overlever fytoplankton en knaphed på kritiske næringsstoffer? Ny undersøgelse forbedrer k…
- Virus skelner, ødelægge E. coli i drikkevand
- Forskerhold løser nøjagtigt eksperimentelt puslespil i højtemperatursuperledning


