Hvad kaldes en kovalent binding, hvor elektroner deles ligeligt?
Eksempler på ikke-polære kovalente bindinger omfatter bindingerne mellem to hydrogenatomer (H-H), to chloratomer (Cl-Cl) og to carbonatomer (C-C). I disse tilfælde har de involverede atomer lignende elektronegativiteter, og elektronerne deles ligeligt mellem dem.
I modsætning hertil er en polær kovalent binding en kovalent binding, hvor elektronerne deles ulige mellem atomerne. Dette sker, når de involverede atomer har forskellige elektronegativiteter, hvilket betyder, at det ene atom har en større tiltrækning af elektroner end det andet. Dette resulterer i, at elektronerne trækkes mod det mere elektronegative atom, og bindingen har en delvis positiv ladning på det mindre elektronegative atom og en delvis negativ ladning på det mere elektronegative atom.
Eksempler på polære kovalente bindinger omfatter bindingerne mellem hydrogen og chlor (H-Cl), hydrogen og oxygen (H-O) og carbon og oxygen (C-O). I disse tilfælde resulterer elektronegativitetsforskellen mellem atomerne i, at elektronerne deles ulige, og bindingerne har en delvis positiv og negativ ladning.
 Varme artikler
Varme artikler
-
 Instant messaging i proteiner opdagetLisa-Marie Funk, medførsteforfatter, analysere proteinkrystaller ved hjælp af et mikroskop forud for besøget i DESY Hamburg. Kredit:Nora Eulig Proteiner er essentielle for enhver levende celle og
Instant messaging i proteiner opdagetLisa-Marie Funk, medførsteforfatter, analysere proteinkrystaller ved hjælp af et mikroskop forud for besøget i DESY Hamburg. Kredit:Nora Eulig Proteiner er essentielle for enhver levende celle og -
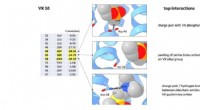 Teamet skaber den første VX-neurotoksindetektor nogensindeEt VX-detekterende protein designet af Koder Lab på CCNY. Kredit:Koder Lab/CCNY City College of New York lektor i fysik Ronald Koder og hans team ved Koder Lab fremmer området for molekylær detekti
Teamet skaber den første VX-neurotoksindetektor nogensindeEt VX-detekterende protein designet af Koder Lab på CCNY. Kredit:Koder Lab/CCNY City College of New York lektor i fysik Ronald Koder og hans team ved Koder Lab fremmer området for molekylær detekti -
 Sætter scenen for brændstofeffektiv gødningKredit:ACS Ammoniak, den primære ingrediens i nitrogenbaserede gødninger, har hjulpet med at brødføde verden siden 1. Verdenskrig. Men at lave ammoniak i industriel skala kræver meget energi, og d
Sætter scenen for brændstofeffektiv gødningKredit:ACS Ammoniak, den primære ingrediens i nitrogenbaserede gødninger, har hjulpet med at brødføde verden siden 1. Verdenskrig. Men at lave ammoniak i industriel skala kræver meget energi, og d -
 Stemplet, espresso, filter? Bare fordi din kaffe er bitter, betyder det ikke, at den er stærkereMoka-gryden, en anden ikonisk italiensk opfindelse, brygger kaffe ved høje temperaturer på en komfur. Kredit:Ccu.bat/Shutterstock Kaffe – en bønne med mange muligheder. Et stort valg er, hvordan ma
Stemplet, espresso, filter? Bare fordi din kaffe er bitter, betyder det ikke, at den er stærkereMoka-gryden, en anden ikonisk italiensk opfindelse, brygger kaffe ved høje temperaturer på en komfur. Kredit:Ccu.bat/Shutterstock Kaffe – en bønne med mange muligheder. Et stort valg er, hvordan ma
- Dokumenter viser, at Volkswagen modsatte sig tilbagekaldelse af Takata-airbag
- Forskere forudser, at det globale energibehov vil stige med 25 % i 2050
- Australien godkender store nye fossile brændselsprojekter
- Forskning giver direkte overblik over tantaloxidation, der hæmmer qubit-kohærens
- NASAs Aqua-satellit viser Rosas-rester, der gennembløder Arizona
- Lodning, hvordan virker


