Hvor mange valenselektroner vil gøre et grundstof glad eller stabilt?
For grundstoffer i den første periode af det periodiske system (brint og helium) indeholder en fuld ydre skal to elektroner. Brint har en elektron og er mest stabil, når den får en elektron mere for at fylde sin ydre skal. Helium har to elektroner og er allerede stabil med en fuld ydre skal.
For grundstoffer i den anden periode af det periodiske system (lithium til neon) indeholder en fuld ydre skal otte elektroner. Lithium har én valenselektron og er mest stabil, når den mister én elektron for at opnå en fuld ydre skal. Beryllium har to valenselektroner og er mest stabilt, når det mister to elektroner for at opnå en fuld ydre skal. Bor har tre valenselektroner og er mest stabil, når den mister tre elektroner for at opnå en fuld ydre skal, og så videre, indtil neon, som har en fuld ydre skal med otte elektroner og derfor er stabil.
For grundstoffer i den tredje periode af det periodiske system (natrium gennem argon) indeholder en fuld ydre skal også otte elektroner. Mønstret med at vinde eller tabe elektroner for at opnå en fuld ydre skal fortsætter, hvor natrium har en valenselektron og er mest stabil, når den mister en elektron, magnesium har to valenselektroner og er mest stabil, når den mister to elektroner, og så videre, indtil argon, som har en fuld ydre skal med otte elektroner og derfor er stabil.
Dette mønster fortsætter for grundstoffer i efterfølgende perioder af det periodiske system, hvor antallet af valenselektroner, der kræves til en fuld ydre skal, stiger, efterhånden som atomnummeret stiger. Ædelgasserne (gruppe 18 grundstoffer), som har en fuld ydre skal med otte elektroner (undtagen helium, som har to), er de mest stabile grundstoffer og har ikke tendens til at reagere med andre grundstoffer.
Sidste artikelHvordan adskiller syrer sig fra basis?
Næste artikelHvad laver kulstof plus ilt?
 Varme artikler
Varme artikler
-
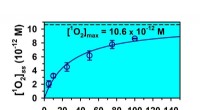 Omdannelse af absorberede fotoner med 2-oxocarboxylsyrer til yderst reaktivt singlet oxygenHøj steady-state singlet iltproduktion, [1O2]ss, under en times bestråling af luftmættede opløsninger af pyruvinsyre i vand. Kredit:Marcelo I. Guzman Forskere ved University of Kentucky fandt ud a
Omdannelse af absorberede fotoner med 2-oxocarboxylsyrer til yderst reaktivt singlet oxygenHøj steady-state singlet iltproduktion, [1O2]ss, under en times bestråling af luftmættede opløsninger af pyruvinsyre i vand. Kredit:Marcelo I. Guzman Forskere ved University of Kentucky fandt ud a -
 En økonomisk legeringsbaseret aerogel som elektrokatalysator til carbonfikseringKredit:Wiley Mange industrielle processer udsender kuldioxid til atmosfæren. Desværre, imidlertid, nuværende elektrokemiske adskillelsesmetoder er dyre og forbruger store mængder strøm. De kræver
En økonomisk legeringsbaseret aerogel som elektrokatalysator til carbonfikseringKredit:Wiley Mange industrielle processer udsender kuldioxid til atmosfæren. Desværre, imidlertid, nuværende elektrokemiske adskillelsesmetoder er dyre og forbruger store mængder strøm. De kræver -
 Ny metode omdanner metan i naturgas til methanol ved stuetemperaturAfbrænding af metan i naturgas bidrager til kulstofemissioner, men metan omdannet til flydende methanol er et renere brændstof. Kredit:Aditya Prajapati og Meenesh Singh/UIC Forskere ved University
Ny metode omdanner metan i naturgas til methanol ved stuetemperaturAfbrænding af metan i naturgas bidrager til kulstofemissioner, men metan omdannet til flydende methanol er et renere brændstof. Kredit:Aditya Prajapati og Meenesh Singh/UIC Forskere ved University -
 Kemikere bruger modificerede DNA -nukleotider til at skabe nye materialerDiagram over enzym (orange) indkapslende 2-azido-DNA/DNA hydrogel. Kredit:Romesberg Lab DNA udviklede sig til at gemme genetisk information, men i princippet denne særlige, kædelignende molekyle k
Kemikere bruger modificerede DNA -nukleotider til at skabe nye materialerDiagram over enzym (orange) indkapslende 2-azido-DNA/DNA hydrogel. Kredit:Romesberg Lab DNA udviklede sig til at gemme genetisk information, men i princippet denne særlige, kædelignende molekyle k
- Ligheden mellem Stivelse og Glykogen
- Tolvte stødstruktur opdaget i det centrale Finland
- Undersøgelsen finder, at individer er mindre tilbøjelige til at vurdere jævnaldrende negativt, hv…
- Forskere finder en usædvanlig måde, hvorpå et materiale leder varme, når det komprimeres
- Lysindeslutning i et 3D-rum
- Britisk cybersikkerhedsekspert går i retten i malware-sag


