Hvordan adskiller syrer sig fra basis?
Syrer er stoffer, der donerer protoner (H+ ioner) til andre stoffer. De er typisk sure i smagen og kan reagere med metaller for at producere brintgas. Nogle almindelige syrer omfatter saltsyre (HCl), svovlsyre (H2SO4) og salpetersyre (HNO3).
Basis er stoffer, der accepterer protoner (H+ ioner) fra andre stoffer. De er typisk bitre i smagen og kan reagere med syrer for at producere vand og salt. Nogle almindelige baser omfatter natriumhydroxid (NaOH), kaliumhydroxid (KOH) og calciumhydroxid (Ca(OH)2).
Styrken af en syre eller base bestemmes af dens evne til at donere eller acceptere protoner. Stærke syrer og baser dissocierer fuldstændigt i vand og frigiver alle deres protoner eller hydroxidioner. Svage syrer og baser dissocierer kun delvist i vand og frigiver kun en lille del af deres protoner eller hydroxidioner.
pH-skalaen bruges til at måle surheden eller basiciteten af en opløsning. pH-skalaen går fra 0 til 14, hvor 7 er neutral. En opløsning med pH under 7 er sur, mens en opløsning med pH over 7 er basisk.
Her er en tabel, der opsummerer de vigtigste forskelle mellem syrer og baser:
| Ejendom | Syre | Base |
|---|---|---|
| Smag | Surt | Bitter |
| Reaktion med metaller | Producerer brintgas | Ingen reaktion |
| Reaktion med syrer | Ingen reaktion | Producerer vand og salt |
| Styrke | Stærke syrer dissocierer fuldstændigt i vand; svage syrer dissocierer kun delvist i vand | Stærke baser dissocierer fuldstændigt i vand; svage baser dissocierer kun delvist i vand |
| pH | Under 7 | Over 7 |
 Varme artikler
Varme artikler
-
 Forskere tilføjer orden til polymergelerEn prøve af den nye homogene polymergel. Kredit:© 2019 Li et al. Gel-lignende materialer har en lang række anvendelser, især inden for kemi og medicin. Imidlertid, deres anvendelighed er undertide
Forskere tilføjer orden til polymergelerEn prøve af den nye homogene polymergel. Kredit:© 2019 Li et al. Gel-lignende materialer har en lang række anvendelser, især inden for kemi og medicin. Imidlertid, deres anvendelighed er undertide -
 Opdagelse kan fjerne mikropollutanter fra miljøetDr. Rong Ye (til venstre), Dr. Ming Zhao (i midten), og Dr. Peng Cheng (til højre) i Cornell diskuterer deres hærfinansierede forskning, der identificerer en ny kemitilgang, der kan fjerne mikropollut
Opdagelse kan fjerne mikropollutanter fra miljøetDr. Rong Ye (til venstre), Dr. Ming Zhao (i midten), og Dr. Peng Cheng (til højre) i Cornell diskuterer deres hærfinansierede forskning, der identificerer en ny kemitilgang, der kan fjerne mikropollut -
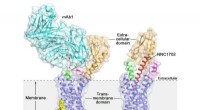 Glukagon-receptorstrukturen giver nye muligheder for at opdage lægemidler til type 2-diabetesKrystalstrukturen af den humane glukagonreceptor i fuld længde (GCGR) krystalstrukturen af den humane glukagonreceptor i fuld længde (GCGR):orange (ekstracellulært domæne), blåt (transmembrant dom
Glukagon-receptorstrukturen giver nye muligheder for at opdage lægemidler til type 2-diabetesKrystalstrukturen af den humane glukagonreceptor i fuld længde (GCGR) krystalstrukturen af den humane glukagonreceptor i fuld længde (GCGR):orange (ekstracellulært domæne), blåt (transmembrant dom -
 Brug af gensakse til at opdage sygdommeI en undersøgelse, forskere ved universitetet i Freiburg introducerer den første elektrokemiske CRISPR-biosensor, der skal hjælpe med at forbedre diagnosticeringen af sygdomme som kræft. Kredit:Rich
Brug af gensakse til at opdage sygdommeI en undersøgelse, forskere ved universitetet i Freiburg introducerer den første elektrokemiske CRISPR-biosensor, der skal hjælpe med at forbedre diagnosticeringen af sygdomme som kræft. Kredit:Rich
- Verdens første model for konstruerede nanopartikler i overfladevand
- Sådan sættes basen Log på Graphing Calculator
- Hvordan omsorgspersoner kan hjælpe med at opbygge børns nye sprogfærdigheder
- De langsomme jordskælv, som vi ikke kan mærke, kan være med til at beskytte mod de ødelæggende
- Fra et vindue til et spejl:Nyt materiale baner vejen for hurtigere databehandling
- Forskere opnår kvantenøglefordeling for cybersikkerhed i et nyt eksperiment


