Glukagon-receptorstrukturen giver nye muligheder for at opdage lægemidler til type 2-diabetes
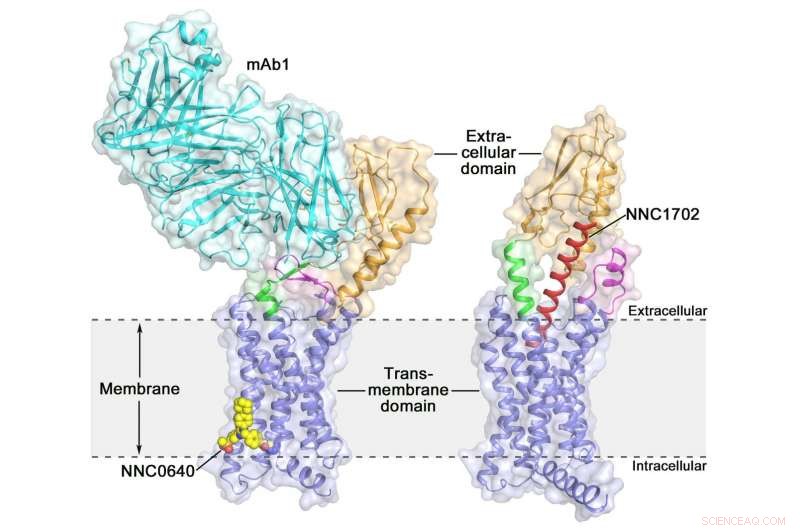
Krystalstrukturen af den humane glukagonreceptor i fuld længde (GCGR) krystalstrukturen af den humane glukagonreceptor i fuld længde (GCGR):orange (ekstracellulært domæne), blåt (transmembrant domæne), grøn (stilk), magenta (den første ekstracellulære sløjfe), rød (NNC1702), gul (NNC0640) og cyan (mAb1) Kredit:Dr. WU Beili
Klasse B G-proteinkoblede receptorer (GPCR'er) udøver essentiel virkning i hormonal homeostase og er vigtige terapeutiske mål for en række sygdomme, herunder metaboliske lidelser såsom type 2-diabetes. Disse receptorer består af et ekstracellulært domæne (ECD) og et transmembrant domæne (TMD), som begge er nødvendige for at interagere med deres beslægtede peptidligander og for at regulere nedstrøms signaltransduktion. På grund af vanskeligheder med proteintilberedning af høj kvalitet, bestemmelse af strukturen af klasse B GPCR'er i fuld længde er fortsat en udfordring, begrænser således forståelsen af molekylære mekanismer for receptorvirkning.
Aktivering af den humane glucagon-receptor (GCGR) med dens endogene ligand glucagon udløser frigivelsen af glucose fra leveren under faste, gør det til et potentielt lægemiddelmål for type 2-diabetes. Sidste år, en gruppe videnskabsmænd ved Shanghai Institute of Materia Medica (SIMM) fra det kinesiske videnskabsakademi bestemte krystalstrukturen af fuldlængde GCGR bundet til en negativ allosterisk modulator NNC0640 og et hæmmende antistof mAb1, giver således for første gang et klart billede af en fuldlængde klasse B GPCR i høj opløsning.
For nylig, forskere ved SIMM bestemte krystalstrukturen af GCGR i kompleks med en glukagonanalog og delvis agonist NNC1702. Denne struktur afslører, for første gang, de molekylære detaljer af en klasse B GPCR, der binder til dets peptidligand i høj opløsning og afslører uventet den strukturelle kompleksitet, der styrer receptoraktivering, derved i høj grad udvide forståelsen af klasse B GPCR-signaltransduktion. Undersøgelsen blev offentliggjort i Natur .
Denne undersøgelse giver nogle værdifulde indsigter i aktiveringsmekanismen for GCGR. Det mest spændende fund er, at linkerregionen, der forbinder receptorens ECD og TMD, kaldet "stilken, " og den første ekstracellulære løkke undergår betydelige konformationelle ændringer i deres sekundære strukturer i den peptidbundne GCGR-struktur sammenlignet med den tidligere bestemte ikke-peptidbundne struktur. Dette fører til en markant ændring i den relative orientering mellem ECD og TMD af receptor for at rumme peptidbinding og initiere receptoraktivering.
Desuden, stilken kan modulere receptoraktivitet ved at lette konformationelle bevægelser af receptor-TMD. "Det er forbløffende at observere, hvordan stilkregionen spiller en så vigtig rolle i reguleringen af receptorfunktionen, selvom det kun indeholder 12 aminosyrer, " sagde SIMM professor Dr. ZHAO Qiang. "Dette er aldrig blevet observeret i tidligere løste GPCR strukturelle undersøgelser. Det uddyber betydeligt viden om klasse B GPCR-signaleringsmekanismer."
Baseret på strukturen af GCGR-NNC1702 kompleks, forskerne udførte en række funktionelle undersøgelser ved hjælp af teknikker som kompetitiv ligandbinding, celle signalering, molekylær dynamik simuleringer og dobbelt elektron-elektron resonansspektroskopi. Resultaterne understøtter GCGR-strukturen og bekræfter de konformationelle ændringer af receptoren i forskellige funktionelle tilstande.
"Den nyligt løste GCGR-struktur giver den mest nøjagtige skabelon til dato for lægemiddeldesign målrettet mod GCGR, som giver nye muligheder inden for opdagelse af lægemidler til behandling af type 2-diabetes, " sagde teamleder og SIMM-professor Dr. WU Beili.
 Varme artikler
Varme artikler
-
 Destabiliseringsprocesser i skumEn stabilisator danner en netlignende struktur på en lille luftboble og understøtter den således. Kredit:ETH Zürich Oktoberfest er en spændende kulturbegivenhed, men det er også en inspirationskil
Destabiliseringsprocesser i skumEn stabilisator danner en netlignende struktur på en lille luftboble og understøtter den således. Kredit:ETH Zürich Oktoberfest er en spændende kulturbegivenhed, men det er også en inspirationskil -
 Upcycling af fast fashion for at reducere spild og forureningGenbrug af bomuld-polyestertøj er tættere på virkeligheden med en ny metode, der kan (1) opløse de blandede materialer, (2) adskiller cellulosen og (3) centrifugerer nye lyocell-lignende fibre. Kredit
Upcycling af fast fashion for at reducere spild og forureningGenbrug af bomuld-polyestertøj er tættere på virkeligheden med en ny metode, der kan (1) opløse de blandede materialer, (2) adskiller cellulosen og (3) centrifugerer nye lyocell-lignende fibre. Kredit -
 Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f
Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f -
 En mere sikker måde for politiet at teste narkotikabeviser påKredit:CC0 Public Domain Forskere har demonstreret en måde, hvorpå politiet hurtigt og sikkert kan teste, om en baggie eller anden pakke indeholder ulovlige stoffer uden at skulle håndtere noget m
En mere sikker måde for politiet at teste narkotikabeviser påKredit:CC0 Public Domain Forskere har demonstreret en måde, hvorpå politiet hurtigt og sikkert kan teste, om en baggie eller anden pakke indeholder ulovlige stoffer uden at skulle håndtere noget m
- NASA ser en ny depression dannes efter den anden svimle
- Coronavirus, jernbaneblokader:Krisehåndteringsplaner beskytter virksomheder
- Coatede zinksulfidnanopartikler er katalytisk aktive
- Forskning forbinder tilbagegang i hemlock-skove til ændringer i vandressourcerne
- Trofæer lavet af menneskelige kranier antyder regionale konflikter omkring tiden for Maya-civilisat…
- Specialiteter på højre side af hjernen


