Hvad sker der, når jernsulfatkrystaller opvarmes?
1. Initial dehydrering: Når jernsulfatkrystaller opvarmes, gennemgår de først dehydrering. Vandmolekyler, der er til stede i krystalgitteret, drives væk, hvilket resulterer i dannelsen af vandfrit ferrosulfat (FeSO4).
FeSO4·7H2O (ferrosulfatheptahydrat) → FeSO4 (vandfrit ferrosulfat) + 7H2O (vanddamp)
2. Dekomponering: Ved yderligere opvarmning begynder vandfrit jernsulfat at nedbrydes. Denne nedbrydning sker i flere trin, der hver frigiver forskellige gasser og producerer forskellige jernoxider:
a) Stage 1: I det første trin nedbrydes ferrosulfat til gasser jernoxid (Fe2O3), svovldioxid (SO2) og svovltrioxid (SO3).
2FeSO4 → Fe2O3 + SO2 + SO3
b) Tape 2: Efterhånden som opvarmningen fortsætter, reagerer det resterende jernoxid yderligere med svovldioxid til dannelse af jernoxid (FeO) og mere svovltrioxid.
Fe2O3 + 2SO2 → 2FeO + SO3
3. Slutlige produkter: De endelige produkter opnået ved fuldstændig nedbrydning af jernsulfatkrystaller er:
- Jernoxid (Fe2O3):et rødbrunt fast stof
- Jernoxid (FeO):et sort fast stof
- Svovldioxid (SO2):en farveløs gas med en skarp lugt
- Svovltrioxid (SO3):en farveløs gas, der reagerer med vand og danner svovlsyre (H2SO4)
Disse nedbrydningsprodukter afhænger af den specifikke temperatur og betingelser for opvarmningsprocessen. I praktiske applikationer udføres den termiske nedbrydning af ferrosulfat ofte som en metode til fremstilling af jernoxider og svovlforbindelser.
 Varme artikler
Varme artikler
-
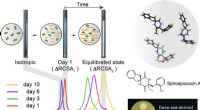 Bestemmelse af atomstrukturen af naturlige produkter hurtigere og mere præcistMåling af den resterende kemiske skiftanisotropi i et flydende krystallinsk medium. Metoden blev brugt til at bestemme stereokemien af spiroepicoccin A, et nyligt opdaget naturprodukt. Det nye natur
Bestemmelse af atomstrukturen af naturlige produkter hurtigere og mere præcistMåling af den resterende kemiske skiftanisotropi i et flydende krystallinsk medium. Metoden blev brugt til at bestemme stereokemien af spiroepicoccin A, et nyligt opdaget naturprodukt. Det nye natur -
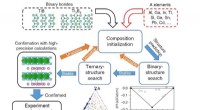 Find en nål i en høstak:Opdagelse af Ti2InB2 til syntetisering af lagdelt TiBMed strategien afbildet, det var muligt at foretage en teoretisk søgning med tusinder af indledende kandidater for endelig at opnå de bedste to MAX -faser for den potentielle syntese af TiB MXenes, so
Find en nål i en høstak:Opdagelse af Ti2InB2 til syntetisering af lagdelt TiBMed strategien afbildet, det var muligt at foretage en teoretisk søgning med tusinder af indledende kandidater for endelig at opnå de bedste to MAX -faser for den potentielle syntese af TiB MXenes, so -
 Flyveaske geopolymerbeton:Betydeligt forbedret modstandsdygtighed over for ekstremt alkaliangrebGeopolymer betonblokke, varmehærdet ved 200 grader Celsius og derefter nedsænket i et ekstremt alkalisk medium i 14 dage ved 80 grader Celsius (a og b), modstå angrebet væsentligt bedre end blokke var
Flyveaske geopolymerbeton:Betydeligt forbedret modstandsdygtighed over for ekstremt alkaliangrebGeopolymer betonblokke, varmehærdet ved 200 grader Celsius og derefter nedsænket i et ekstremt alkalisk medium i 14 dage ved 80 grader Celsius (a og b), modstå angrebet væsentligt bedre end blokke var -
 Bæredygtig nylonproduktion muliggjort ved opdagelse af bakterierArbejde med adipinsyrebakterier i Wallace Lab, University of Edinburgh. Kredit:The Wallace Lab, University of Edinburgh Nylonfremstilling kan revolutioneres ved opdagelsen af, at bakterier kan gør
Bæredygtig nylonproduktion muliggjort ved opdagelse af bakterierArbejde med adipinsyrebakterier i Wallace Lab, University of Edinburgh. Kredit:The Wallace Lab, University of Edinburgh Nylonfremstilling kan revolutioneres ved opdagelsen af, at bakterier kan gør
- Gennemsigtig film afviser 70 procent af indgående solvarme
- Det hele er i twisten:Fysikere stabler 2D-materialer i vinkler for at fange partikler
- Sådan opretter du en Shoebox Solar Oven
- Forskere udvikler ny metode til at sætte kvantekorrelationer på prøve
- Hvordan man ikke bryder banken på streamingtjenester
- Hvordan man besvarer argumentet om, at Australiens emissioner er for små til at gøre en forskel


