Hvor elektroner er ligeligt delt, siges bindingen at være en hvilken slags binding?
Kovalente bindinger er resultatet af overlapningen af atomare orbitaler, som er de områder omkring kernen af et atom, hvor der er størst sandsynlighed for, at elektroner findes. Når to atomare orbitaler overlapper hinanden, kan elektronerne i disse orbitaler parre sig og danne en kovalent binding. Styrken af den kovalente binding afhænger af mængden af overlap mellem de atomare orbitaler.
Kovalente bindinger dannes typisk mellem atomer med lignende elektronegativiteter, hvilket er et mål for et atoms evne til at tiltrække elektroner. Når atomer med forskellige elektronegativiteter binder, deles elektronerne ikke ligeligt, og den resulterende binding siges at være polær kovalent. I en polær kovalent binding har det ene atom en svag positiv ladning, og det andet atom har en svag negativ ladning.
Kovalente bindinger er meget vigtige i organisk kemi, som er studiet af kulstofbaserede molekyler. Kulstofatomer er i stand til at danne fire kovalente bindinger, hvilket giver dem mulighed for at danne en lang række komplekse molekyler.
 Varme artikler
Varme artikler
-
 Forvandling af pollen til 3D-printblæk til biomedicinske applikationerDenne pollen-afledte blæk udviklet af NTU Singapore (i røret) er i stand til at holde sin form, når den afsættes på en overflade, gør det til et levedygtigt alternativ til nuværende blæk, der bruges t
Forvandling af pollen til 3D-printblæk til biomedicinske applikationerDenne pollen-afledte blæk udviklet af NTU Singapore (i røret) er i stand til at holde sin form, når den afsættes på en overflade, gør det til et levedygtigt alternativ til nuværende blæk, der bruges t -
 E-affaldsspisende protein skaber sjældne jordarterDenne illustration viser lanmodulin, et lille protein, som er et bio-source alternativ til ekstrakt, rense og genbruge sjældne jordarters grundstoffer fra forskellige kilder, herunder elektronisk affa
E-affaldsspisende protein skaber sjældne jordarterDenne illustration viser lanmodulin, et lille protein, som er et bio-source alternativ til ekstrakt, rense og genbruge sjældne jordarters grundstoffer fra forskellige kilder, herunder elektronisk affa -
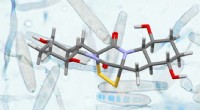 En ny strategi for syntese af komplekse naturlige produkterStruktur af Rostratin A (forgrund) og svampen exserohilum rostratum, hvorfra den blev isoleret (baggrund). Kredit:Universitetet i Basel, Olivier Baudoin mit Erlaubnis af G. Roberts Det er lykkedes
En ny strategi for syntese af komplekse naturlige produkterStruktur af Rostratin A (forgrund) og svampen exserohilum rostratum, hvorfra den blev isoleret (baggrund). Kredit:Universitetet i Basel, Olivier Baudoin mit Erlaubnis af G. Roberts Det er lykkedes -
 Atomisk opfattelse af naturens fantastiske molekylære maskiner på arbejdeMetoden hit and return (HARE) forenkler optagelse af snapshot-film af biomolekyler på arbejdet. Kredit:J. M. Harms, MPSD Forskere fra MPSDs Institut for Atomically Resolved Dynamics ved Center for
Atomisk opfattelse af naturens fantastiske molekylære maskiner på arbejdeMetoden hit and return (HARE) forenkler optagelse af snapshot-film af biomolekyler på arbejdet. Kredit:J. M. Harms, MPSD Forskere fra MPSDs Institut for Atomically Resolved Dynamics ved Center for
- Hvilken partikelformig luftforurening udgør den største sundhedsrisiko?
- Amazons digitale assistent Alexa får ny færdighed:hukommelsestab
- NASA ser Ramon degenerere til et trug
- Hvad sker der med de kemiske og fysiske egenskaber af et stof, der dannes ved reaktion?
- Hvordan økonomiske vanskeligheder påvirker valgdeltagelsen
- Giver pay-to-play sport, fritidsaktiviteter uden for rækkevidde for nogle elever?


