Hvordan dannes et brintmolekyle fra to atomer?
1. Valenselektroner:Hvert brintatom har én valenselektron, som er en elektron i den yderste skal, der deltager i kemiske reaktioner.
2. Elektrondeling:For at opnå en mere stabil elektronkonfiguration bidrager hvert brintatom med sin valenselektron til at danne et fælles elektronpar.
3. Elektronpar:Det delte elektronpar er placeret mellem de to brintatomer, hvilket skaber et område med høj elektrontæthed kaldet en kovalent binding.
4. Hydrogenmolekyle:Den resulterende struktur, med to brintatomer bundet sammen af en kovalent binding, danner et molekyle af brintgas (H2).
I et brintmolekyle deles begge elektroner ligeligt mellem de to brintatomer, hvilket opnår en stabil elektronkonfiguration med en konfiguration af helium i dette tilfælde. Denne deling af elektroner sænker molekylets samlede energi, hvilket gør det mere stabilt end de adskilte brintatomer.
Den kovalente binding i brintmolekyle er en yderst effektiv måde for atomerne at opnå stabilitet på. Det demonstrerer også det grundlæggende princip om kovalent binding, hvorved atomer deler elektroner for at opnå et mere energisk gunstigt arrangement.
Sidste artikelHvordan kan du kende forskel på en zink- og bronzepenning?
Næste artikelHvilken kobbersulfatopløsning og kaliumiodid?
 Varme artikler
Varme artikler
-
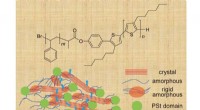 Elektrisk forbedring:Ingeniører fremskynder elektroner i halvledereKemisk struktur af poly(P3HT)- b -(PSt) og et diagram over plausible hultransportveje i P3HT- b -PSt. Kreditering:Figur tilpasset med tilladelse fra forsiden af Macromol. Chem. Phys. 18/2018, Jo
Elektrisk forbedring:Ingeniører fremskynder elektroner i halvledereKemisk struktur af poly(P3HT)- b -(PSt) og et diagram over plausible hultransportveje i P3HT- b -PSt. Kreditering:Figur tilpasset med tilladelse fra forsiden af Macromol. Chem. Phys. 18/2018, Jo -
 Det rigtige valg af malm kan skabe lavere emissionerTrine Asklund Larssen har undersøgt, hvordan forskellige slags malm i metalproduktion påvirker energiforbrug og udledning. Kredit:Vincent Canaguier, SINTEF I Norge, metalproduktion tegner sig for
Det rigtige valg af malm kan skabe lavere emissionerTrine Asklund Larssen har undersøgt, hvordan forskellige slags malm i metalproduktion påvirker energiforbrug og udledning. Kredit:Vincent Canaguier, SINTEF I Norge, metalproduktion tegner sig for -
 Video:Kemien i stegt kyllingKredit:The American Chemical Society Pisket og friturestegt kylling kan være en af de lækreste fødevarer nogensinde. Men hvad er det, der gør denne sommer picnic hæfteklammer så velsmagende? De
Video:Kemien i stegt kyllingKredit:The American Chemical Society Pisket og friturestegt kylling kan være en af de lækreste fødevarer nogensinde. Men hvad er det, der gør denne sommer picnic hæfteklammer så velsmagende? De -
 Bladinspireret overflade forhindrer frostdannelseFrost dannes på de konvekse områder af blade, men ikke på de konkave årer. Kredit:Stephan Herb Forskere fra Northwestern University opdagede en ny måde at reducere frostdannelsen på enhver overfla
Bladinspireret overflade forhindrer frostdannelseFrost dannes på de konvekse områder af blade, men ikke på de konkave årer. Kredit:Stephan Herb Forskere fra Northwestern University opdagede en ny måde at reducere frostdannelsen på enhver overfla
- Star Wars-figurernes kostumer afspejler skiftet fra magt til romantik
- Gennembrud inden for industriel nanorørbehandling
- Hvad er det kemiske navn på stensalt?
- Hvordan bakterier producerer manganoxid-nanopartikler
- Fremkomsten af samarbejde:Team beskriver matematisk vigtigheden af samarbejde og omdømme
- Folk synes, de burde tale mindre for at blive holdt af, men ny forskning tyder på, at de skal tale …


