Hvad ville danne en elektrolytopløsning?
Nogle almindelige eksempler på elektrolytopløsninger omfatter:
* Natriumchlorid (NaCl) opløsning :Når natriumchlorid opløses i vand, adskilles natrium- og chloridionerne og bliver omgivet af vandmolekyler. Natriumionerne har en positiv ladning, mens chloridionerne har en negativ ladning. Bevægelsen af disse ioner i opløsningen gør det muligt for den at lede elektricitet.
* Svovlsyre (H2SO4) opløsning :Når svovlsyre opløses i vand, adskilles hydrogenionerne (H+) og sulfationerne (SO42-) og bliver omgivet af vandmolekyler. Hydrogenionerne har en positiv ladning, mens sulfationerne har en negativ ladning. Bevægelsen af disse ioner i opløsningen gør det muligt for den at lede elektricitet.
* Kobbersulfat (CuSO4) opløsning :Når kobbersulfat er opløst i vand, adskilles kobberionerne (Cu2+) og sulfationerne (SO42-) og bliver omgivet af vandmolekyler. Kobberionerne har en positiv ladning, mens sulfationerne har en negativ ladning. Bevægelsen af disse ioner i opløsningen gør det muligt for den at lede elektricitet.
Elektrolytopløsninger er vigtige i mange biologiske processer, såsom overførsel af nerveimpulser og sammentrækning af muskler. De bruges også i mange industrielle applikationer, såsom galvanisering og batterier.
Sidste artikelHvad er syre i træ?
Næste artikelFår eller mister kovalente bindinger ikke elektroner?
 Varme artikler
Varme artikler
-
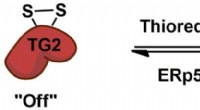 Leder efter en afbryder til cøliakiTransglutaminase 2 (TG2) reguleres reversibelt af proteincofaktorerne thioredoxin og ERp57 via en allosterisk disulfid redox switch. Kredit:Chaitan Khosla, Stanford University Cøliaki er en autoim
Leder efter en afbryder til cøliakiTransglutaminase 2 (TG2) reguleres reversibelt af proteincofaktorerne thioredoxin og ERp57 via en allosterisk disulfid redox switch. Kredit:Chaitan Khosla, Stanford University Cøliaki er en autoim -
 Enzym kan få en nøglerolle i lægemiddeldesign til brystkræft og hjernesygdomKredit:Københavns Universitet I de seneste år, forskere har fokuseret på enzymet TLK2, mistænkes for at spille en hovedrolle i flere sygdomme. En ny undersøgelse foretaget på Københavns Universite
Enzym kan få en nøglerolle i lægemiddeldesign til brystkræft og hjernesygdomKredit:Københavns Universitet I de seneste år, forskere har fokuseret på enzymet TLK2, mistænkes for at spille en hovedrolle i flere sygdomme. En ny undersøgelse foretaget på Københavns Universite -
 Enheden kunne høre sygdom gennem strukturer, der huser cellerEn enhed bruger lydbølger til at detektere stivheden af en ekstracellulær matrix, et strukturelt netværk, der indeholder celler. Ændringer i stivheden af denne struktur kan indikere spredning af s
Enheden kunne høre sygdom gennem strukturer, der huser cellerEn enhed bruger lydbølger til at detektere stivheden af en ekstracellulær matrix, et strukturelt netværk, der indeholder celler. Ændringer i stivheden af denne struktur kan indikere spredning af s -
 Modellering af Jordens kemi:Gør det usynlige synligtDenne 3D -gengivelse af en bakke er kombineret med en reaktiv transportmodelsimulering af iltet vand, der strømmer gennem stenet materiale. Fordelingen af ilt styres af biologisk forbrug, reaktioner
Modellering af Jordens kemi:Gør det usynlige synligtDenne 3D -gengivelse af en bakke er kombineret med en reaktiv transportmodelsimulering af iltet vand, der strømmer gennem stenet materiale. Fordelingen af ilt styres af biologisk forbrug, reaktioner
- Hvad er deformation i jordens videnskab?
- Nye forbindelser viser lovende i kampen mod tuberkulose og neurodegenerative sygdomme
- Hvor er du en oversigt over Facebooks steder
- Hvilken del af en plantecelle samler lysenergi?
- Supermoon glæder skykiggere over hele kloden
- Forskere sporer Twitter for at lære, hvad folk værdsætter i New York Citys parker


