Hvilken beskrivelse gælder for rigtige gasser frem for ideelle gasser?
1. Intermolekylære kræfter: Ægte gaspartikler udviser tiltrækkende og frastødende kræfter mellem hinanden, kendt som intermolekylære kræfter. Disse kræfter påvirker gassens adfærd, især ved høje tryk, når partiklerne er tæt pakket.
2. Endelig volumen af gaspartikler: I modsætning til ideelle gasser har ægte gaspartikler en begrænset størrelse og optager en del plads. Dette bliver væsentligt ved høje tryk, fordi det effektive volumen, der er tilgængeligt for partikelbevægelse, falder.
3. Ikke-tilfældig molekylær bevægelse: Antagelsen om fuldstændig tilfældig molekylær bevægelse i ideelle gasser gælder ikke for rigtige gasser. Intermolekylære kræfter kan introducere korrelationer og mønstre i bevægelsen af rigtige gaspartikler.
4. Variable kollisioner: I rigtige gasser er kollisioner mellem partikler ikke perfekt elastiske som antaget i den ideelle gasmodel. Interaktionerne mellem partikler resulterer i energioverførsel og indre energiændringer, hvilket påvirker tryk-volumen-temperatur-forholdet.
Afvigelserne fra ideel adfærd er beskrevet af tilstandsligninger, såsom van der Waals-ligningen, der redegør for virkningerne af intermolekylære kræfter og endeligt partikelvolumen. Ægte gasser nærmer sig ideel adfærd ved høje temperaturer og lave tryk, hvor indflydelsen af disse faktorer bliver ubetydelig.
Sidste artikelHvilken forbindelse danner aluminium og jod?
Næste artikelHvilket forklarer hvorfor kulstof er så alsidigt et grundstof?
 Varme artikler
Varme artikler
-
 En corny løsning til at hjælpe med at bekæmpe spredningen af den nye coronavirusKarakteristisk for denne håndsprit kommer fra dens ethanolbase. Ethanol er en plantebaseret vedvarende energikilde-i USA primært fremstillet af majs-der ofte blandes med benzin til køretøjer. Kredit:U
En corny løsning til at hjælpe med at bekæmpe spredningen af den nye coronavirusKarakteristisk for denne håndsprit kommer fra dens ethanolbase. Ethanol er en plantebaseret vedvarende energikilde-i USA primært fremstillet af majs-der ofte blandes med benzin til køretøjer. Kredit:U -
 Nanostrukturering øger effektiviteten af metalfrie fotokatalysatorer med faktor 11PCN -nanolag under sollys kan splitte vand. Kredit:Nannan Meng /Tianjin University En af de store udfordringer ved overgangen til vedvarende energi er at levere energi, selv i mangel af sollys. Br
Nanostrukturering øger effektiviteten af metalfrie fotokatalysatorer med faktor 11PCN -nanolag under sollys kan splitte vand. Kredit:Nannan Meng /Tianjin University En af de store udfordringer ved overgangen til vedvarende energi er at levere energi, selv i mangel af sollys. Br -
 Afvikling af mysteriet med forringede spole-til-spole-båndEn brun klæbende skur-rester på et spole-til-hjul-bånd, der ikke kan spilles, er vist samle sig ved en afspilningsmaskines kontaktpunkter; resterne forsvinder ved opvarmning. Kredit:Andrew R. Davis
Afvikling af mysteriet med forringede spole-til-spole-båndEn brun klæbende skur-rester på et spole-til-hjul-bånd, der ikke kan spilles, er vist samle sig ved en afspilningsmaskines kontaktpunkter; resterne forsvinder ved opvarmning. Kredit:Andrew R. Davis -
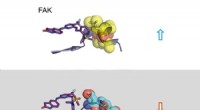 Når aktivt stof og målprotein omfavner hinandenØverste del:Lang opholdstid. En inhibitor (til venstre:stick -model) binder sig til signalmolekylet FAK (til højre:en del af FAK -proteinet afbildet som calottemodel med kugler). Strukturændringen af
Når aktivt stof og målprotein omfavner hinandenØverste del:Lang opholdstid. En inhibitor (til venstre:stick -model) binder sig til signalmolekylet FAK (til højre:en del af FAK -proteinet afbildet som calottemodel med kugler). Strukturændringen af
- Selv små gaver øger forretningen
- Karakteristika for de seks kongedømme af organismer
- Kulstofbrug:Hvordan landbruget både kan fodre mennesker og bekæmpe klimaændringer
- Bobler følger med strømmen:Simulerer opførsel af væsker, der bevæger sig gennem rør
- Californiens strande eroderer:En ekspert forklarer, hvordan man redder dem
- Kunne mini-Neptunes være bestrålede havplaneter?


