Hvad er styrken, hvis en syre afhænger af?
1. Ioniseringsgrad:
- Jo stærkere syren er, jo mere fuldstændig dissocierer den eller ioniserer den i vand og frigiver flere H+ ioner.
- Omfanget af ionisering måles ved syredissociationskonstanten (Ka). En højere Ka-værdi indikerer en stærkere syre, da den dissocierer mere omfattende i vand.
2. Koncentration af hydroniumioner (H3O+):
- Styrken af en syre er direkte proportional med koncentrationen af hydroniumioner, der dannes, når den opløses i vand.
- Stærke syrer giver en højere koncentration af H3O+, mens svage syrer giver en lavere koncentration.
3. pH-værdi:
- pH-værdien af en opløsning er et mål for dens surhed eller basicitet. Det bestemmes af koncentrationen af H3O+ ioner.
- Stærke syrer har en lavere pH-værdi (indikerer højere surhedsgrad), fordi de frigiver flere H3O+-ioner, hvorimod svage syrer har en højere pH-værdi.
4. Struktur og elektronegativitet:
- Syrens kemiske struktur og elektronegativitet spiller også en rolle for dens styrke.
- Syrer med mere elektronegative atomer, såsom oxygen eller fluor, har en tendens til at være stærkere, fordi de mere effektivt kan tiltrække elektroner fra O-H-bindingen, hvilket fører til en større frigivelse af H+-ioner.
5. Temperatur:
- Generelt stiger styrken af en syre med temperaturen. Dette skyldes, at højere temperaturer giver mere energi til at overvinde de kræfter, der holder molekylerne sammen, hvilket resulterer i øget ionisering. Temperaturens effekt på syrestyrken kan dog være forbindelsesspecifik.
6. Opløsningsmiddeleffekter:
- Styrken af en syre kan også påvirkes af det opløsningsmiddel, den er opløst i. Nogle opløsningsmidler, såsom vand, har en højere dielektricitetskonstant og kan stabilisere ioner bedre, hvilket fremmer ionisering og øger syrens styrke.
Disse faktorer bidrager tilsammen til styrken af en syre og bestemmer dens evne til at donere H+ ioner og dens indvirkning på en opløsnings surhedsgrad.
Sidste artikelBrænder alle syrer igennem ting?
Næste artikelHvad bestemmer styrken af en syre?
 Varme artikler
Varme artikler
-
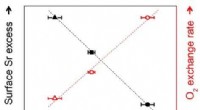 Brændselscellernes levetid maksimeres ved hjælp af en lille mængde metallerKorrelation mellem omfanget af gitterstamme i elektrode, strontiumsegregering, og elektrodereaktion. Kredit:KAIST Brændselsceller er en vigtig fremtidig energiteknologi, der fremstår som miljøvenl
Brændselscellernes levetid maksimeres ved hjælp af en lille mængde metallerKorrelation mellem omfanget af gitterstamme i elektrode, strontiumsegregering, og elektrodereaktion. Kredit:KAIST Brændselsceller er en vigtig fremtidig energiteknologi, der fremstår som miljøvenl -
 VTT udviklede en optisk fiber fremstillet af celluloseVTT udviklede en optisk fiber fremstillet af cellulose. Optisk fiber fremstillet af cellulose er bedst egnet til sensorer, der drager fordel af materialets bionedbrydelighed. Kredit:VTT VTT-forske
VTT udviklede en optisk fiber fremstillet af celluloseVTT udviklede en optisk fiber fremstillet af cellulose. Optisk fiber fremstillet af cellulose er bedst egnet til sensorer, der drager fordel af materialets bionedbrydelighed. Kredit:VTT VTT-forske -
 Atomisk opfattelse af naturens fantastiske molekylære maskiner på arbejdeMetoden hit and return (HARE) forenkler optagelse af snapshot-film af biomolekyler på arbejdet. Kredit:J. M. Harms, MPSD Forskere fra MPSDs Institut for Atomically Resolved Dynamics ved Center for
Atomisk opfattelse af naturens fantastiske molekylære maskiner på arbejdeMetoden hit and return (HARE) forenkler optagelse af snapshot-film af biomolekyler på arbejdet. Kredit:J. M. Harms, MPSD Forskere fra MPSDs Institut for Atomically Resolved Dynamics ved Center for -
 Biokemikere opdager mekanisme, der hjælper influenzavirus med at udvikle sigVirion vandrere med varierende fitness, illustreret her som beredskab, forsøg på at klatre Folded Peak Mens nogle virioner er for uegnede til at ramme sporet (rød), nogle er tilstrækkeligt egnede til
Biokemikere opdager mekanisme, der hjælper influenzavirus med at udvikle sigVirion vandrere med varierende fitness, illustreret her som beredskab, forsøg på at klatre Folded Peak Mens nogle virioner er for uegnede til at ramme sporet (rød), nogle er tilstrækkeligt egnede til
- Miljøvenlig lignin nanopartikel greens sølv nanobullet til at bekæmpe bakterier
- Bag hyl af solvind, stille kvidren afslører dens oprindelse
- Ulemperne ved gelelektroforese
- Materialuafhængig nanocoating antimikrobiel spray forlænger produkternes holdbarhed
- Hvordan fælles elementer kan gøre en mere energisikker fremtid
- Katalysator gør nervestoffer harmløse


