Hvad bestemmer styrken af en syre?
1. Dissociationsgrad :Styrken af en syre er direkte proportional med graden af dens dissociation i vand. En stærk syre dissocierer næsten fuldstændigt i vand og frigiver en høj koncentration af hydrogenioner (H+). På den anden side dissocierer en svag syre kun delvist, hvilket resulterer i en lavere koncentration af H+ ioner.
2. Koncentration af hydroniumioner (H3O+): Styrken af en syre måles i forhold til dens hydroniumionkoncentration, [H3O+]. Jo højere [H3O+] en opløsning er, desto stærkere er syren. Stærke syrer har en højere [H3O+] end svage syrer.
3. Ioniseringskonstant (Ka): Ioniseringskonstanten, Ka, er et mål for, i hvilket omfang en syre dissocierer i vand. Det udtrykkes som ligevægtskonstanten for syrens dissociationsreaktion. En stærk syre har en høj Ka-værdi, hvilket indikerer en større tendens til at dissociere, mens en svag syre har en lav Ka-værdi, hvilket indikerer en mindre tendens til at dissociere.
4. pH: En opløsnings pH er et mål for dens surhedsgrad eller basicitet. Det bestemmes af koncentrationen af H3O+ ioner. En stærk syre har en lav pH (under 7) på grund af dens høje [H3O+] koncentration, mens en svag syre har en højere pH (tættere på 7) på grund af dens lavere [H3O+] koncentration.
Sammenfattende bestemmes styrken af en syre af graden af dissociation, koncentrationen af hydroniumioner ([H3O+]), ioniseringskonstanten (Ka) og opløsningens resulterende pH. Stærke syrer har en høj grad af dissociation, høj [H3O+], høj Ka og lav pH, mens svage syrer har en lav grad af dissociation, lav [H3O+], lav Ka og en pH tættere på 7.
Sidste artikelHvad er styrken, hvis en syre afhænger af?
Næste artikelHvad er oxidationstallet for nitrogen i N2H5Cl?
 Varme artikler
Varme artikler
-
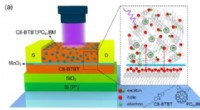 Forskere udvikler ultrafølsomme organiske fototransistorer baseret på en ny hybridlagsarkitekturStrukturen af hybrid-lag fototransistor. Kredit:LI Jia Organiske fototransistorer (OPTer) er meget udbredt i miljø-/sundhedsovervågning, kvantekommunikation, kemisk/biomedicinsk sansning, fjernb
Forskere udvikler ultrafølsomme organiske fototransistorer baseret på en ny hybridlagsarkitekturStrukturen af hybrid-lag fototransistor. Kredit:LI Jia Organiske fototransistorer (OPTer) er meget udbredt i miljø-/sundhedsovervågning, kvantekommunikation, kemisk/biomedicinsk sansning, fjernb -
 Resonansforbedret tunneling inducerer flour- og para-hydrogenreaktion i interstellare skyerDe høje søjler og runde kugler af mørkt støv og kold molekylær gas i stjerneskyer Kredit:T. A. Rector &B. A. Wolpa, NOAO, AURA Forskere fra Dalian Institute of Chemical Physics (DICP) fra det kine
Resonansforbedret tunneling inducerer flour- og para-hydrogenreaktion i interstellare skyerDe høje søjler og runde kugler af mørkt støv og kold molekylær gas i stjerneskyer Kredit:T. A. Rector &B. A. Wolpa, NOAO, AURA Forskere fra Dalian Institute of Chemical Physics (DICP) fra det kine -
 Kend din cement, få grønnere betonBeton er det mest brugte byggemateriale i verden - dets fremstilling bidrager med så meget som 8 procent af kuldioxiden til atmosfæren. Kredit:Eugenesergeev, iStock Et internationalt hold af forsk
Kend din cement, få grønnere betonBeton er det mest brugte byggemateriale i verden - dets fremstilling bidrager med så meget som 8 procent af kuldioxiden til atmosfæren. Kredit:Eugenesergeev, iStock Et internationalt hold af forsk -
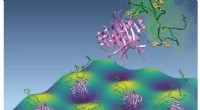 Skyerne af spaghetti, der holder DNA-data sikreForskere ved Rockefeller University og Albert Einstein College of Medicine har identificeret en finurlig biofysisk mekanisme, der hjælper celler med at undgå databrud. Kredit:Michael Cowburn og David
Skyerne af spaghetti, der holder DNA-data sikreForskere ved Rockefeller University og Albert Einstein College of Medicine har identificeret en finurlig biofysisk mekanisme, der hjælper celler med at undgå databrud. Kredit:Michael Cowburn og David
- Ny analyse viser, hvordan svovlskyer kan dannes i Venus-atmosfæren
- Klimaændringer får de schweiziske alper til at tilføje over 1, 000 søer:undersøgelse
- Teknik til fremstilling af mikrodråbelinser
- Erindring om fortidens strid:Papirhvepse viser overraskende stærk hukommelse for tidligere møder
- Caffaus stjerne er en dværg, Det bekræfter Gaia DR2
- Før du investerer i kryptovaluta, Læs dette


