Hvorfor er metaborsyre og tetrapyrosyre ustabile i opløsning?
I tilfælde af metaborsyre kan hydrolysereaktionen repræsenteres som følger:
H3BO3 + H2O → B(OH)4- + H+
Denne reaktion resulterer i dannelsen af borsyre (B(OH)3) og en hydrogenion (H+). Tetrapyrosyren gennemgår en lignende hydrolysereaktion for at danne pyroborsyre (H2B4O7) og hydrogenioner:
H2B4O7 + H2O → 2B(OH)4- + 2H+
Disse hydrolysereaktioner er typisk langsomme ved stuetemperatur, men de kan fremskyndes af tilstedeværelsen af syrer eller baser, som kan katalysere reaktionerne. Som følge heraf bruges metaborsyre og tetrapyrosyrer generelt ikke i applikationer, hvor de vil blive udsat for vand eller andre kilder til fugt.
Sidste artikelHvilke metaller korroderer svovlsyre?
Næste artikelHvad er fordelene ved element sølv?
 Varme artikler
Varme artikler
-
 Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti
Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti -
 Ingeniører identificerer forbedrede membraner til at opfange CO2 på kulfyrede kraftværkerAfbildning af en metalorganisk ramme (HKUST-1) indlejret i en polymermatrix, der skal bruges som membran til effektiv gasseparation. Kredit:Kutay Sezginel/Hypothetical Materials Lab En beregningsm
Ingeniører identificerer forbedrede membraner til at opfange CO2 på kulfyrede kraftværkerAfbildning af en metalorganisk ramme (HKUST-1) indlejret i en polymermatrix, der skal bruges som membran til effektiv gasseparation. Kredit:Kutay Sezginel/Hypothetical Materials Lab En beregningsm -
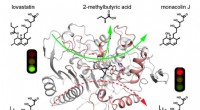 Forskere afslører den katalytiske mekanisme af lovastatinhydrolaseLovastatinhydrolase PcEST katalyserer specifikt og effektivt omdannelsen af lovastatin til monacolin J, men kan ikke hydrolysere simvastatin Kredit:LIANG Yajing Hyperlipidæmi, en af de mest al
Forskere afslører den katalytiske mekanisme af lovastatinhydrolaseLovastatinhydrolase PcEST katalyserer specifikt og effektivt omdannelsen af lovastatin til monacolin J, men kan ikke hydrolysere simvastatin Kredit:LIANG Yajing Hyperlipidæmi, en af de mest al -
 Molekyleundersøgelser afslører potentiel behandling for patienter med slagtilfældeEn tegneserierepræsentation afsløret af undersøgelsen viser den lukkede tilstand af PDZ-domænerne. Kredit: Naturkommunikation , doi:10.1038/s41467-018-06133-0 I en forlængelse af forskning offent
Molekyleundersøgelser afslører potentiel behandling for patienter med slagtilfældeEn tegneserierepræsentation afsløret af undersøgelsen viser den lukkede tilstand af PDZ-domænerne. Kredit: Naturkommunikation , doi:10.1038/s41467-018-06133-0 I en forlængelse af forskning offent
- Hvorfor kaldes visse aminosyrer essentielle syrer?
- Forskere bruger nanosensorer for første gang til at måle kræftbiomarkører i blod
- Et unikt scanning tunnelmikroskop med magnetisk køling til at studere kvanteeffekter
- Hvad er farven på gas, der dannes ved at kombinere kobber og salpetersyre?
- Kan du huske mig? Køn, race kan gøre dig forglemmelig
- Hvordan en af det nordlige Californiens mest forurenede ejendomme endelig kan blive ryddet op


