Beregn antallet af C- og O-atomer til stede i 11,2 liter kuldioxid ved STP?
Volumen af kuldioxid =11,2L
Temperatur (T) =273K
Tryk (P) =1 atm
Nu skal vi finde antallet af mol CO2, der er til stede i 11,2L,
PV =nRT
hvor P =tryk,
V=volumen,
N=antal mol,
R=gaskonstant, og
T =temperatur
Ved at sætte værdier får vi
$$\Højrepil 1\ gange 11.2=n\ gange 0.0821\ gange 273$$
$$\Rightarrow n=\frac{11.2}{22.4}=0,5mol$$
Der er 0,5 mol kuldioxid i 11,2 liter ved STP.
Da 1 mol kuldioxid indeholder 1 mol kulstofatomer og 2 mol oxygenatomer.
Så 0,5 mol kuldioxid indeholder 0,5 mol kulstofatomer og 1 mol oxygenatomer.
Derfor er antallet af kulstofatomer i 11,2 liter kuldioxid ved STP
$$=0,5\ gange 6,023\ gange 10^{23}$$
$$=3,0115\ gange 10^{23}$$
Antallet af oxygenatomer i 11,2 liter kuldioxid ved STP
$$=1\ gange 6.023\ gange 10^{23}$$
$$=6,023\ gange 10^{23}$$
Sidste artikelHvor mange uparrede elektroner har Nd?
Næste artikelNavnet på syren i orange?
 Varme artikler
Varme artikler
-
 Smart svamp kunne rense oliespildSmart svamp absorberer selektivt olie (til venstre), mens den modstår vand (til højre). Kredit:Northwestern University Et team ledet af Northwestern University har udviklet en meget porøs smart sv
Smart svamp kunne rense oliespildSmart svamp absorberer selektivt olie (til venstre), mens den modstår vand (til højre). Kredit:Northwestern University Et team ledet af Northwestern University har udviklet en meget porøs smart sv -
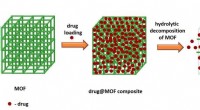 Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu
Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu -
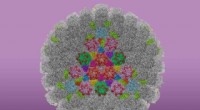 Studiet producerer de klareste billeder til dato af HSV-1, virus, der forårsager forkølelsessårForskere brugte en metode kaldet subparticle raffinement til at fange detaljerede strukturelle oplysninger om HSV-1 partiklen. Kredit:California NanoSystems Institute ved UCLA UCLA-forskere har pr
Studiet producerer de klareste billeder til dato af HSV-1, virus, der forårsager forkølelsessårForskere brugte en metode kaldet subparticle raffinement til at fange detaljerede strukturelle oplysninger om HSV-1 partiklen. Kredit:California NanoSystems Institute ved UCLA UCLA-forskere har pr -
 Nyt kompositmateriale har potentiale til medicinsk brugProfessor Gajanan Bhat holder et elastisk nonwoven-materiale. Kredit:Andrew Davis Tucker/UGA Forskere fra University of Georgia har udviklet et nyt materiale med egenskaber, der er ideelle til med
Nyt kompositmateriale har potentiale til medicinsk brugProfessor Gajanan Bhat holder et elastisk nonwoven-materiale. Kredit:Andrew Davis Tucker/UGA Forskere fra University of Georgia har udviklet et nyt materiale med egenskaber, der er ideelle til med
- Hvad er opløseligheden af olieeddikesyre?
- Næringsstoffer gør koralblegning værre
- Hvordan bider hajtænder? Stempelsav, lim giver svar
- Tredimensionelle fossile alger, der er mere end 541 millioner år gamle, afslører planterigets mode…
- Bevis på en anden mulig planet, der kredser om Proxima Centauri
- Sætter skovbrandssod et præg på verdenshavene?


