Hvilket stof fungerer som buffer i naturligt vand?
Det vigtigste buffersystem i naturlige farvande er kulsyre-bicarbonat-carbonat-systemet.
* Kulsyre ($H_2CO_3$) er en svag syre, der dannes, når kuldioxid ($CO_2$) opløses i vand.
* Bikarbonat ($HCO_3^-$) er den konjugerede base af kulsyre.
* Karbonat ($CO_3^{2-}$) er den konjugerede base af bicarbonat.
Ligevægtsreaktionerne mellem disse tre arter kan repræsenteres som følger:
$$CO_2_{(g)} + H_2O_{(l)} \rightleftharpoons H_2CO_{3(aq)}$$
$$H_2CO_{3(aq)} \rightleftharpoons H^+_{(aq)} + HCO_{3(aq)}^-{}$$
$$HCO_{3(aq)}^- \rightleftharpoons H^+_{(aq)} + CO_{3(aq)}^{2-}$$
De relative koncentrationer af disse tre arter afhænger af vandets pH. Ved lav pH er koncentrationen af kulsyre højest, mens ved høj pH er koncentrationen af karbonat højest. Bikarbonat er den dominerende art ved en pH-værdi på omkring 8,3, hvilket er den gennemsnitlige pH-værdi i naturligt vand.
Kulsyre-bicarbonat-carbonat-systemet fungerer som en buffer i naturligt vand, fordi det kan reagere med både syrer og baser for at opretholde en relativt konstant pH.
* Når en syre tilsættes til et naturligt vand, vil bikarbonat- og carbonationerne reagere med brintionerne og danne kulsyre, hvilket reducerer vandets surhedsgrad.
* Når en base tilsættes til et naturligt vand, vil kulsyren reagere med hydroxidionerne og danne bikarbonat- og carbonationer, og dermed reducere vandets basicitet.
Sidste artikelHvad er oxidationstallet for Cu?
Næste artikelHvad mener du med jernholdigt og ikke jernholdigt?
 Varme artikler
Varme artikler
-
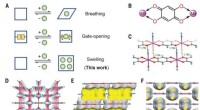 Brug af en manganpolymer til at adskille xylenisomererMn-dhbqs struktur og poreegenskaber. (A) Repræsentationer af forskellige former for rammedynamik eller fleksibilitet:vejrtrækning, portåbning-lukning eller linkerrotation og hævelse. (B) Koordinations
Brug af en manganpolymer til at adskille xylenisomererMn-dhbqs struktur og poreegenskaber. (A) Repræsentationer af forskellige former for rammedynamik eller fleksibilitet:vejrtrækning, portåbning-lukning eller linkerrotation og hævelse. (B) Koordinations -
 Guld mikrojuveler fra 3-D printerenLaserudskrivningsteknikken:ved at udskrive kobber og guld på skift, guldspiralen er oprindeligt omgivet af en kobberkasse. Ætser kobberet væk, resulterer i en fritstående helix af rent guld. Kredit:Un
Guld mikrojuveler fra 3-D printerenLaserudskrivningsteknikken:ved at udskrive kobber og guld på skift, guldspiralen er oprindeligt omgivet af en kobberkasse. Ætser kobberet væk, resulterer i en fritstående helix af rent guld. Kredit:Un -
 Forskere finder tegn på proteinfoldning på stedet for intracellulære dråberKredit: Kemisk videnskab (2020). DOI:10.1039/D0SC04993J Forskere har opdaget det første tegn på proteinfoldning drevet af væske-væskefaseseparation, et fænomen, hvor væsker dannes til mikroskopis
Forskere finder tegn på proteinfoldning på stedet for intracellulære dråberKredit: Kemisk videnskab (2020). DOI:10.1039/D0SC04993J Forskere har opdaget det første tegn på proteinfoldning drevet af væske-væskefaseseparation, et fænomen, hvor væsker dannes til mikroskopis -
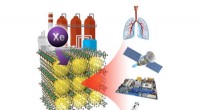 Sammenføjning af xenongas ud af affaldsstrømmeMetal organiske rammer, med nanoporer og høj affinitet for xenon, kan adskille gassen fra luft eller affaldsstrømme. Xenon har applikationer inden for forskellige områder, herunder belysning, rumfremd
Sammenføjning af xenongas ud af affaldsstrømmeMetal organiske rammer, med nanoporer og høj affinitet for xenon, kan adskille gassen fra luft eller affaldsstrømme. Xenon har applikationer inden for forskellige områder, herunder belysning, rumfremd
- Hvorfor er DNA næsten altid en højrehåndet helix? Udforskning af årsagerne til chiralitet
- Du dumpede kabel? Comcast håber at få dig tilbage
- Hvilke lande er i den polære zone?
- At lave bucky-balls i spin-outs seværdigheder
- Oprindelsen af lineær magnetoresistens - eksotisk eller klassisk?
- Socialt gode skaber økonomisk løft


