Hvorfor tab af elektroner kaldes oxidation?
I moderne kemi er oxidation defineret som tab af elektroner. Dette kan forekomme, når et atom eller molekyle overfører elektroner til et andet atom eller molekyle, eller når et atom eller molekyle mister elektroner til et eksternt elektrisk felt.
Det modsatte af oxidation er reduktion, som defineres som forstærkningen af elektroner.
Grunden til, at tab af elektroner kaldes oxidation, er fordi oxidation i mange tilfælde er ledsaget af tilsætning af ilt. For eksempel, når jern ruster, mister jernatomerne elektroner til oxygenatomer og danner jernoxid.
Der er dog mange tilfælde, hvor oxidation ikke involverer tilsætning af ilt. For eksempel, når kobber reagerer med saltsyre, mister kobberatomerne elektroner til brintatomer og danner kobberchlorid og brintgas.
På trods af det faktum, at oxidation ikke altid involverer tilsætning af oxygen, bruges udtrykket "oxidation" stadig til at beskrive disse reaktioner på grund af dets historiske oprindelse.
Her er nogle eksempler på oxidations-reduktionsreaktioner:
* Forbrænding: Når et stof brænder, reagerer det med ilt og producerer varme og lys. Iltatomerne får elektroner fra brændstoffet, som oxideres.
* Rustning: Jern ruster, når det kommer i kontakt med ilt og vand. Jernatomerne mister elektroner til oxygenatomer og danner jernoxid.
* Elektrolyse: Elektrolyse er processen med at bruge en elektrisk strøm til at adskille en forbindelse i dens bestanddele. Elektroden, der taber elektroner, oxideres, mens den elektrode, der får elektroner, reduceres.
Oxidationsreduktionsreaktioner er afgørende for mange biologiske processer, såsom fotosyntese og respiration. De bruges også i mange industrielle processer, såsom produktion af stål og raffinering af olie.
Sidste artikelOpløses jernoxid i vand?
Næste artikelHvordan hænger oxidation sammen i kemiske reaktioner?
 Varme artikler
Varme artikler
-
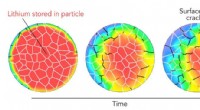 Forskere undersøger kemien i en enkelt batterielektrodepartikel både inde og udeEn simulering baseret på røntgenforsøg hos SLAC viser, hvad der sker med en enkelt batterielektrodepartikel, når den oplades i løbet af 12 minutter. Partiklen svulmer og krymper, når lithiumioner komm
Forskere undersøger kemien i en enkelt batterielektrodepartikel både inde og udeEn simulering baseret på røntgenforsøg hos SLAC viser, hvad der sker med en enkelt batterielektrodepartikel, når den oplades i løbet af 12 minutter. Partiklen svulmer og krymper, når lithiumioner komm -
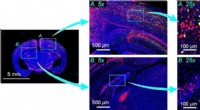 Optisk billeddannelsessystem kan fange et hidtil uset antal celler i et enkelt billedeFig.1:Billeddannelse af et musehjerneskive. Et flerfarvet billede af en musehjerneskive med to områder angivet med lyseblå firkanter, nemlig, hjernebarken (A) og hippocampus (B). Disse vises i hele-hj
Optisk billeddannelsessystem kan fange et hidtil uset antal celler i et enkelt billedeFig.1:Billeddannelse af et musehjerneskive. Et flerfarvet billede af en musehjerneskive med to områder angivet med lyseblå firkanter, nemlig, hjernebarken (A) og hippocampus (B). Disse vises i hele-hj -
 Edderkoppesilke kunne bruges som robotmuskelTvunget silke fra en Nephila pilipes edderkop. Kredit:Liu et al., Sci. Adv . 2019; 5:eaau9183 Edderkoppesilke, allerede kendt som et af de stærkeste materialer for sin vægt, viser sig at have en
Edderkoppesilke kunne bruges som robotmuskelTvunget silke fra en Nephila pilipes edderkop. Kredit:Liu et al., Sci. Adv . 2019; 5:eaau9183 Edderkoppesilke, allerede kendt som et af de stærkeste materialer for sin vægt, viser sig at have en -
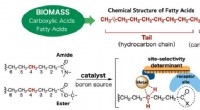 Et nyt værktøj til at skabe kemisk kompleksitet fra fedtsyrerDen nyudviklede katalysator (midterste bund) består af et metal (iridium) atom i kernen og forskellige moduler, der sikrer, at fedtsyreamid eller ester er præcist placeret på en måde, så CH -bindingen
Et nyt værktøj til at skabe kemisk kompleksitet fra fedtsyrerDen nyudviklede katalysator (midterste bund) består af et metal (iridium) atom i kernen og forskellige moduler, der sikrer, at fedtsyreamid eller ester er præcist placeret på en måde, så CH -bindingen
- Ingeniører opfinder banebrydende spin-baseret hukommelsesenhed
- Intet at nyse af:Eksperimentel model viser, at pollen kan ændre vejret
- Hvad er den kemiske formel for limonade?
- US startup ser næste generation af burgere med velbehag
- Planeter af binære stjerner som mulige hjem for fremmede liv
- Bangladeshs kraftige nedbør undersøgt med NASAs IMERG


