Opløses jernoxid i vand?
1.Hydrolyse og dannelse af hydrerede jernoxider:
Jernoxid kan reagere med vand og danne hydrerede jernoxider. Denne proces er kendt som hydrolyse. Hydrerede jernoxider, såsom ferrihydrit (Fe5HO8·4H2O) eller goethit (FeOOH), har en vis opløselighed i vand. Opløseligheden af hydrerede jernoxider afhænger af faktorer som pH, temperatur og tilstedeværelsen af andre ioner.
2.Kompleks dannelse:
Jernoxid kan reagere med visse ligander eller kompleksdannende midler til stede i vand for at danne opløselige komplekser. For eksempel kan organiske ligander som citrat, oxalat eller EDTA (ethylendiamintetraeddikesyre) danne opløselige komplekser med jern, hvilket øger dets opløselighed i vand.
3.Redox-reaktioner:
I nærvær af reduktionsmidler eller under sure forhold kan jernoxid undergå redoxreaktioner, der ændrer dets opløselighed. For eksempel, i et surt miljø med tilstedeværelsen af reduktionsmidler som svovlholdige forbindelser, kan jernoxid reduceres til mere opløselige former for jern, såsom Fe2+ (jernholdigt jern).
4.PH's indflydelse:
Opløseligheden af jernoxid er påvirket af pH. Generelt er jernoxider mere opløselige under sure forhold sammenlignet med neutrale eller alkaliske forhold. I sure miljøer kan hydrogenioner (H+) reagere med jernoxid og danne mere opløselige komplekser.
Det er værd at bemærke, at opløseligheden af jernoxid i vand er relativt lav, og det betragtes generelt som en uopløselig forbindelse. Under specifikke kemiske forhold eller i nærvær af kompleksdannende midler kan dets opløselighed dog øges. Omfanget af opløselighed afhænger også af den specifikke type jernoxid til stede og de omgivende miljøforhold.
Sidste artikelHvilken farve har hydrogensulfat?
Næste artikelHvorfor tab af elektroner kaldes oxidation?
 Varme artikler
Varme artikler
-
 Befri oceanerne for plastik ved at omdanne affaldet til værdifuldt brændstofJames Holm (billedet) og Swaminathan Ramesh, Ph.D., gik sammen om at udvikle en mobil reaktor (også på billedet) til at omdanne affaldsplastik til brændstof. Kredit:Claudia Rocha Milliarder af pou
Befri oceanerne for plastik ved at omdanne affaldet til værdifuldt brændstofJames Holm (billedet) og Swaminathan Ramesh, Ph.D., gik sammen om at udvikle en mobil reaktor (også på billedet) til at omdanne affaldsplastik til brændstof. Kredit:Claudia Rocha Milliarder af pou -
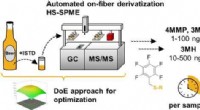 Sniffing af frugtagtige thioler i hoppede ølKredit:American Chemical Society Hoppy øl som blege øl bliver stadig mere populære. En grund er deres behagelige frugtagtige aroma, der delvist stammer fra forbindelser kaldet thioler. Bryggerier
Sniffing af frugtagtige thioler i hoppede ølKredit:American Chemical Society Hoppy øl som blege øl bliver stadig mere populære. En grund er deres behagelige frugtagtige aroma, der delvist stammer fra forbindelser kaldet thioler. Bryggerier -
 Udforskning af fordelene ved defekter i laserfremstillede materialerKredit:CC0 Public Domain Metal additive manufacturing (AM) lover at revolutionere den måde, vi producerer og bruger visse dele på. Reducering af materialespild og arbejdstid, metal AM forenkler tr
Udforskning af fordelene ved defekter i laserfremstillede materialerKredit:CC0 Public Domain Metal additive manufacturing (AM) lover at revolutionere den måde, vi producerer og bruger visse dele på. Reducering af materialespild og arbejdstid, metal AM forenkler tr -
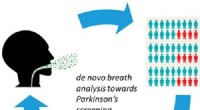 En udåndingstest for Parkinsons tidligt stadieKredit:American Chemical Society Symptomer på Parkinsons sygdom omfatter tremor, lugttab og neuropsykiatriske problemer. Imidlertid, mange mennesker bliver ikke diagnosticeret, før deres sygdom er
En udåndingstest for Parkinsons tidligt stadieKredit:American Chemical Society Symptomer på Parkinsons sygdom omfatter tremor, lugttab og neuropsykiatriske problemer. Imidlertid, mange mennesker bliver ikke diagnosticeret, før deres sygdom er
- Den gennemsnitlige nedbør i et økosystem med ferskvand
- Ingeniører lærer en drone at flokke fugle væk fra lufthavne autonomt
- Hvordan en kæmpe termokandeflaske vil hjælpe med at forstå antimateriale
- Fusion, nogen? Ikke helt endnu, men forskere viser, hvor tæt vi er kommet
- Forskere drejer på kontakten for at gøre mikrosensorer superfølsomme over for biomolekyler
- Detaljeret billede afslører, hvordan tandemaljen er stærk nok til at holde livet ud


