Hvordan hænger oxidation sammen i kemiske reaktioner?
I en kemisk reaktion er arten, der gennemgår oxidation, kendt som reduktionsmidlet, mens arten, der gennemgår reduktion, er kendt som oxidationsmidlet. Reduktionsmidlet donerer elektroner til oxidationsmidlet, hvilket bevirker, at reduktionsmidlet oxideres og oxidationsmidlet reduceres.
Det følgende er en forenklet fremstilling af en oxidations-reduktionsreaktion:
Reduktionsmiddel + Oxidationsmiddel → Oxideret Reduktionsmiddel + Reduceret Oxidationsmiddel
Overvej for eksempel følgende reaktion mellem jern og kobber:
Fe(s) + Cu2+(aq) → Fe2+(aq) + Cu(s)
I denne reaktion oxideres jern (Fe) fra en neutral tilstand (Fe0) til en +2 oxidationstilstand (Fe2+). Samtidig reduceres kobber (Cu) fra en +2 oxidationstilstand (Cu2+) til en neutral tilstand (Cu0). Jern fungerer som reduktionsmiddel, donerer elektroner til kobber, mens kobber fungerer som oxidationsmiddel, der accepterer elektroner fra jern.
Begrebet oxidation og reduktion er afgørende for at forstå forskellige kemiske processer, herunder forbrænding, respiration og fotosyntese. Ved forbrænding gennemgår brændstoffer som kulbrinter oxidationsreaktioner med ilt, hvilket frigiver energi i form af varme og lys. I respiration gennemgår glucose en række oxidationsreaktioner for at generere energi til celler. I fotosyntesen bruger planter sollys til at omdanne kuldioxid og vand til glukose gennem en række oxidations-reduktionsreaktioner.
Overordnet set er oxidation og reduktion grundlæggende begreber i kemi, der hjælper med at forklare stoffers adfærd og interaktioner under kemiske reaktioner.
 Varme artikler
Varme artikler
-
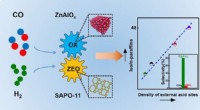 Direkte syntese af isoparaffinrig benzin fra syngasDirekte syngaskonvertering til isoparaffinrig benzin over OXZEO-katalysator. Kredit:Feng Jingyao Et forskerhold ledet af prof. Pan Xiulian og prof. Bao Xinhe fra Dalian Institute of Chemical Physic
Direkte syntese af isoparaffinrig benzin fra syngasDirekte syngaskonvertering til isoparaffinrig benzin over OXZEO-katalysator. Kredit:Feng Jingyao Et forskerhold ledet af prof. Pan Xiulian og prof. Bao Xinhe fra Dalian Institute of Chemical Physic -
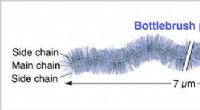 Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy
Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy -
 Thermodynamiske egenskaber ved heveinGummi latex Hevea brasiliensis . Kredit:Lobachevsky University Hevein er et lille protein (4,7 kDa) bestående af 43 aminosyrerester. Det er hovedkomponenten i bundfraktionen af gummitræ ( Hev
Thermodynamiske egenskaber ved heveinGummi latex Hevea brasiliensis . Kredit:Lobachevsky University Hevein er et lille protein (4,7 kDa) bestående af 43 aminosyrerester. Det er hovedkomponenten i bundfraktionen af gummitræ ( Hev -
 Udfordrer en central grundsætning i kemiKredit:CC0 Public Domain Steve Granick, Direktør for IBS Center for Soft and Living Matter og Dr. Huan Wang, Seniorforsker, rapport sammen med 5 tværfaglige kolleger i tidsskriftets 31. juli-udgav
Udfordrer en central grundsætning i kemiKredit:CC0 Public Domain Steve Granick, Direktør for IBS Center for Soft and Living Matter og Dr. Huan Wang, Seniorforsker, rapport sammen med 5 tværfaglige kolleger i tidsskriftets 31. juli-udgav
- Arque er en søheste-inspireret kunstig hale
- Tanzanianske landmænd øger kosten, mental sundhed med bæredygtige metoder
- To hovedorganeller af eukaryoter, der deler træk med hinanden og bakterier, som de tilsyneladende s…
- Dødelig storm fortæller om to byer i Macau
- Et fuldstændigt billede af oprindelsen og naturen af havaffald
- Den tyske presse nedgør afvigende røster om klimaændringer


