En grund til, at vand er et effektivt opløsningsmiddel det?
1. Polaritet:Vandmolekyler er polære, hvilket betyder, at de har en delvis positiv ladning på den ene side af molekylet og en delvis negativ ladning på den anden side. Denne polaritet gør det muligt for vandmolekyler at danne hydrogenbindinger med andre polære molekyler og ioner, opløse dem og holde dem i opløsning.
2. Hydrogenbinding:Hydrogenbinding er en stærk intermolekylær kraft, der opstår mellem vandmolekyler og andre polære molekyler eller ioner. Disse hydrogenbindinger hjælper med at bryde molekylstrukturen af opløste stoffer fra hinanden, så de kan blandes og opløses i vand.
3. Høj dielektrisk konstant:Et stofs dielektriske konstant er et mål for dets evne til at reducere de elektrostatiske kræfter mellem ladede partikler. Vand har en høj dielektrisk konstant, hvilket betyder, at det effektivt kan reducere den elektrostatiske tiltrækning mellem ioner, hvilket giver dem mulighed for at forblive spredt i opløsning.
4. Overfladespænding:Vand har en høj overfladespænding på grund af den stærke hydrogenbinding mellem dets molekyler. Denne overfladespænding skaber en barriere ved vandoverfladen, som kan fange og fastholde visse stoffer som olier og fedtstoffer og forhindre dem i at opløses.
5. Temperaturafhængig opløselighed:Mange stoffers opløselighed i vand stiger med temperaturen. Dette skyldes, at højere temperaturer giver mere energi til at overvinde interaktionerne mellem opløst stof og opløsningsmiddel-opløst stof, hvilket tillader flere opløste partikler at opløses i vandet.
Vands polaritet, hydrogenbinding, høje dielektricitetskonstant, overfladespænding og temperaturafhængige opløselighed gør det til et effektivt opløsningsmiddel for en lang række stoffer, herunder uorganiske salte, organiske forbindelser, sukkerarter, syrer, baser og mange hverdagsmaterialer.
Sidste artikelEr kobber et metal ikke-metal eller metalloid?
Næste artikelHvorfor er alkalier farlige?
 Varme artikler
Varme artikler
-
 Forskerteam udvikler sonde til batteriforskningResultater fra en ny metode til analyse af uordnede krystallinske materialer. Røde steder besat med stor sandsynlighed; blå steder stort set ubeboet. Billedet viser, at natriumioner er i overensstemme
Forskerteam udvikler sonde til batteriforskningResultater fra en ny metode til analyse af uordnede krystallinske materialer. Røde steder besat med stor sandsynlighed; blå steder stort set ubeboet. Billedet viser, at natriumioner er i overensstemme -
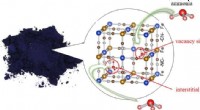 Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker
Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker -
 Team afslører overraskende detaljer om afgørende energiproducerende enzymNebraskas Oleh Khalimonchuk har hjulpet med at opklare længe skjulte detaljer om dannelsen af cytochrom c-oxidase (venstre), et enzym, der er afgørende for at producere den energi, der driver alle m
Team afslører overraskende detaljer om afgørende energiproducerende enzymNebraskas Oleh Khalimonchuk har hjulpet med at opklare længe skjulte detaljer om dannelsen af cytochrom c-oxidase (venstre), et enzym, der er afgørende for at producere den energi, der driver alle m -
 En uventet virkemåde for et antistofFor at illustrere den funktionelle mimik opdaget i antistoffer mod SARS-coronavirus, en mime holder i hånden SARS-CoV S bundet til ACE2-receptoren (blågrøn). Hans refleksion viser et SARS-CoV S bundet
En uventet virkemåde for et antistofFor at illustrere den funktionelle mimik opdaget i antistoffer mod SARS-coronavirus, en mime holder i hånden SARS-CoV S bundet til ACE2-receptoren (blågrøn). Hans refleksion viser et SARS-CoV S bundet
- Beskyttelse af bredbånds RF-systemer i overbelastede elektromagnetiske miljøer
- Hvordan virker ATP?
- Beskyttelse af dyreliv begynder med at forstå, hvordan man bedst kan imødegå dyrelivsforbrydelser…
- Hvordan kombineres atomer og danner molekyler gennem ionbinding?
- Reduceret strømforbrug i halvlederenheder
- En ny undersøgelse udforsker humor i ordindlejringer


