Hvad ville være kemisk ændring af aluminium?
1. Oxidation:Aluminium reagerer let med oxygen og danner aluminiumoxid (Al2O3). Denne proces er kendt som oxidation og opstår, når aluminium udsættes for luft eller vand. Oxidlaget beskytter metallet mod yderligere korrosion.
2. Reaktion med syrer:Aluminium reagerer med syrer for at producere brintgas og et salt af aluminium. For eksempel, når aluminium anbringes i saltsyre (HCl), reagerer det og danner aluminiumchlorid (AlCl3) og brintgas (H2).
3. Reaktion med alkalier:Aluminium reagerer med alkalier og danner en opløselig alumination (AlO2-). For eksempel, når aluminium tilsættes til natriumhydroxid (NaOH), reagerer det og danner natriumaluminat (NaAlO2) og hydrogengas (H2).
4. Forbrænding:Når aluminium opvarmes i nærvær af ilt, gennemgår det en meget eksoterm reaktion, der frigiver en stor mængde varme og lys. Denne proces er kendt som forbrænding og resulterer i dannelsen af aluminiumoxid.
5. Reduktion:Aluminium kan reduceres fra dets forbindelser med mere reaktive metaller, såsom natrium eller kalium. For eksempel, når aluminiumoxid opvarmes med natrium, gennemgår det en reduktionsreaktion for at danne aluminiummetal og natriumoxid.
Sidste artikelEr en snemand kemisk forandring?
Næste artikelHvad er fordelen ved at transportere svovl som væske?
 Varme artikler
Varme artikler
-
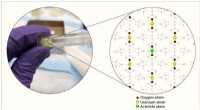 Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk
Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk -
 Samhørighedsforskere afslører mysteriet om brintvirkninger på materialerFig. 1. Total hydrogenfordeling i stål efter 3% trækbelastning belastning svarende til hydrogentryk på (a) 1 bar, (b) 100 bar, (c) 200 bar og (d) 1000 bar. Kredit:Delft University of Technology Br
Samhørighedsforskere afslører mysteriet om brintvirkninger på materialerFig. 1. Total hydrogenfordeling i stål efter 3% trækbelastning belastning svarende til hydrogentryk på (a) 1 bar, (b) 100 bar, (c) 200 bar og (d) 1000 bar. Kredit:Delft University of Technology Br -
 Innovativ katalytisk reaktion til billig syntese af aromatiske estereKredit:CC0 Public Domain Aromatiske estere er kemikalier, der indeholder en aromatisk ring bestående af funktionelle grupper kaldet estere. Disse organiske forbindelser bruges i vid udstrækning so
Innovativ katalytisk reaktion til billig syntese af aromatiske estereKredit:CC0 Public Domain Aromatiske estere er kemikalier, der indeholder en aromatisk ring bestående af funktionelle grupper kaldet estere. Disse organiske forbindelser bruges i vid udstrækning so -
 Nyt center til at erstatte olie og gas med bæredygtig kemiKredit:Københavns Universitet Mange af de ting, der omgiver os, er kemisk afledt af fossil gas og olie - fra vaskepulver til telefoner til lægemidler. Som sådan, kemi bidrager til CO 2 emissione
Nyt center til at erstatte olie og gas med bæredygtig kemiKredit:Københavns Universitet Mange af de ting, der omgiver os, er kemisk afledt af fossil gas og olie - fra vaskepulver til telefoner til lægemidler. Som sådan, kemi bidrager til CO 2 emissione


