Hvorfor virker H plus-ionen som en Lewis-syre?
For eksempel, når H+-ionen kommer i kontakt med vandmolekylet, vil H+-ionen acceptere det enlige elektronpar på vandmolekylets oxygenatom og danne en binding med oxygenatomet. Denne reaktion kan repræsenteres som følger:
H+ + H2O → H3O+
H3O+ ionen er en hydroniumion, som er en stabil ion, der findes i vand. Dannelsen af hydronium-ionen er et eksempel på, hvordan H+-ionen kan fungere som en Lewis-syre.
H+-ionen kan også fungere som en Lewis-syre i andre reaktioner. For eksempel kan H+-ionen reagere med hydroxidionen og danne vand:
H+ + OH- → H2O
Denne reaktion er et eksempel på, hvordan H+-ionen kan acceptere et par elektroner fra en base.
H+-ionen er en stærk Lewis-syre, hvilket betyder, at den har en stærk tiltrækning af elektroner. Dette er grunden til, at H+-ionen kan reagere med en lang række forskellige molekyler og ioner for at danne bindinger.
 Varme artikler
Varme artikler
-
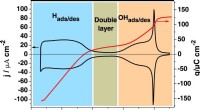 Ny forståelse af nøglebrændselscellekatalysatorTopmoderne for Pt(111). Cyklisk voltammogram (sort linje, venstre akse) og ladningstæthedskurve (rød linje, højre akse) for Pt (111) optaget i 0,1 M HClO4-opløsning ved en scanningshastighed på 50 mV
Ny forståelse af nøglebrændselscellekatalysatorTopmoderne for Pt(111). Cyklisk voltammogram (sort linje, venstre akse) og ladningstæthedskurve (rød linje, højre akse) for Pt (111) optaget i 0,1 M HClO4-opløsning ved en scanningshastighed på 50 mV -
 Røntgenlasersyn afslører lægemiddelmålKredit:Elena Khavina/MIPT Forskere fra Moskva Institut for Fysik og Teknologi har offentliggjort en anmeldelse om seriel femtosekundkrystallografi, en af de mest lovende metoder til at analysere
Røntgenlasersyn afslører lægemiddelmålKredit:Elena Khavina/MIPT Forskere fra Moskva Institut for Fysik og Teknologi har offentliggjort en anmeldelse om seriel femtosekundkrystallografi, en af de mest lovende metoder til at analysere -
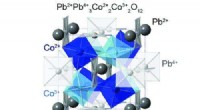 Blandede valenstilstande i blyperovskitterKrystalstruktur af Pb2+Pb4+3Co2+2Co3+2O12, hvor Pb og Co har ladningsordener på trods af den simple PbCoO3-kemiske sammensætning og valensfordelingsændringer for PbMO3 (M:3d overgangsmetal). Kredit: J
Blandede valenstilstande i blyperovskitterKrystalstruktur af Pb2+Pb4+3Co2+2Co3+2O12, hvor Pb og Co har ladningsordener på trods af den simple PbCoO3-kemiske sammensætning og valensfordelingsændringer for PbMO3 (M:3d overgangsmetal). Kredit: J -
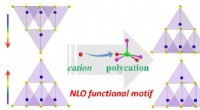 Bredspektrede NLO-materialer opnået ved polykation-substitution-induceret NLO-funktionel motivbesti…Skematisk illustration af rekonstruktion af NLO-funktionelt motiv på en parallel måde via polykation-substitution-induceret CS-til-NCS transformationsstrategi. Kredit:Prof. GUOs gruppe Ikke-lineær
Bredspektrede NLO-materialer opnået ved polykation-substitution-induceret NLO-funktionel motivbesti…Skematisk illustration af rekonstruktion af NLO-funktionelt motiv på en parallel måde via polykation-substitution-induceret CS-til-NCS transformationsstrategi. Kredit:Prof. GUOs gruppe Ikke-lineær
- Nyt projekt for at øge nøjagtigheden til positionering af satellitnavigationer overalt i verden
- Fylder kattetandlæger dig med frygt?
- Apple har design til blodtryksstyringssystem
- Astronauter starter rumvandringsserie for at reparere kosmisk stråledetektor
- Filippinsk vulkan bøvser mørk fane, landsbyboere evakueret
- Nanostrukturerede tynde film, der kan bøje lys i store vinkler, kan være en erstatning for omfangs…


