Røntgenlasersyn afslører lægemiddelmål

Kredit:Elena Khavina/MIPT
Forskere fra Moskva Institut for Fysik og Teknologi har offentliggjort en anmeldelse om seriel femtosekundkrystallografi, en af de mest lovende metoder til at analysere den tertiære struktur af proteiner. Denne teknik har udviklet sig hurtigt i løbet af det sidste årti, åbne nye perspektiver for det rationelle design af lægemidler rettet mod proteiner, der tidligere var utilgængelige for strukturelle analyser. Artiklen udkom i bladet Ekspertudtalelse om Drug Discovery .
Røntgen krystallografi
Røntgenkrystallografi er en af de vigtigste metoder til at afsløre 3D-strukturen af biologiske makromolekyler, såsom proteiner. Det har hjulpet med at bestemme strukturen af adskillige farmakologisk vigtige enzymer og receptorer, muliggør design af lægemidler rettet mod disse proteiner.
Metoden går ud på at krystallisere et protein og studere det via røntgendiffraktion. Først isoleres og renses proteinet. Derefter tørrer opløsningsmidlet gradvist ud. Som resultat, de molekyler, hvis struktur bliver undersøgt, danner krystaller, præget af en indre orden. Ved at udsætte en krystal for røntgenstråler i en speciel enhed, forskere opnår et diffraktionsmønster. Den indeholder information om atomernes positioner i krystallen. En nøje analyse af mønsteret afslører 3D-strukturen af de konstituerende proteinmolekyler.
Før fremkomsten af denne metode, nye lægemidler blev for det meste søgt empirisk:enten ved at ændre strukturen af de molekyler, der vides at påvirke målproteinet, eller ved at sortere gennem arrays af molekyler i kemiske biblioteker. Nu hvor 3D-strukturerne af mange målproteiner er tilgængelige, forskere kan se dem på en computerskærm og hurtigt sortere gennem millioner af forbindelser, der søger efter lægemiddelkandidater. På den måde sparer de meget tid og penge tidligere brugt på kemisk syntese og "våde" eksperimenter.
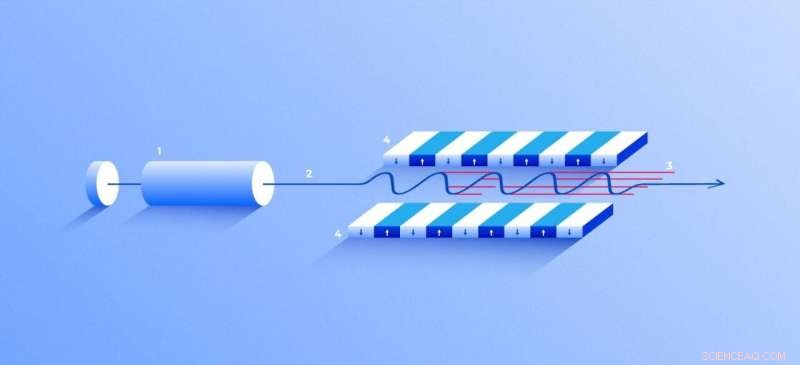
Røntgen-fri-elektron-laser. En kilde (1) udsender frie elektroner (2), der bevæger sig kun 10 gange langsommere end lysets hastighed gennem undulatoren (4), en tunnel foret med mange magneter. Magnetfeltet får en elektron, der rejser gennem tunnelen, til at oscillere og derfor udsende røntgenstråler. Bevægelsen af elektronerne i undulatoren er synkroniseret for at generere tætte, højfrekvente røntgenimpulser af bemærkelsesværdig intensitet (3). Kredit:Elena Khavina/MIPT
Røntgenkrystallografi giver gode resultater for krystaller, der er store, stabil, og homogen - dvs. uden urenheder eller strukturelle defekter. For bedre at detektere et svagt diffraktionssignal, en kraftig strålingsimpuls er nødvendig, men ikke så kraftig, at den ødelægger krystallen. I konventionel røntgenkrystallografi, en proteinkrystal roteres i røntgenstrålen for at producere diffraktionsmønstre for forskellige rumlige orienteringer. Dette fanger maksimal information om strukturen.
Metode til vanskelige mål
Kort efter at røntgenkrystallografi dukkede op, det blev klart, at ikke alle biologiske makromolekyler kan krystalliseres. Nogle proteiner er normalt opløst i det indre cellemedium. Så det er ret nemt at sætte dem i løsning, fordamp det, og få en stor almindelig krystal. Men membranproteiner, mange receptorer blandt dem, danner krystaller, der ikke er store og rene nok til standard røntgenkrystallografi. Det sagt, mange af disse proteiner er involveret i sygdomsudvikling, hvilket betyder, at deres struktur er af stor interesse for farmakologer.
For mindre end ti år siden, der blev fundet en opløsning for membranproteiner. Denne nye teknik, kaldet seriel femtosekund røntgenkrystallografi, eller SFX, er afhængig af røntgen-frielektronlasere, udviklet kort før SFX.
Alexey Mishin, souschef for Laboratoriet for Strukturel Biologi af Receptorer ved MIPT, der var medforfatter til undersøgelsen, forklaret:"Det, der gør det til en banebrydende teknologi, er en meget høj energitæthed af laserpulsen. Objektet er udsat for så kraftig stråling, at det falder fra hinanden, uundgåeligt og næsten øjeblikkeligt. Men før det sker, nogle individuelle kvanta af laserpulsen spredes fra prøven og ender ved detektoren. Dette er det såkaldte diffraktion-før-destruktion-princip til at studere strukturen af det originale protein."

To måder til at føre krystaller ind i enhedens driftsområde:i en væskestrøm (3, venstre) og på et fast underlag (3, ret). I begge tilfælde, røntgenstrålen (2), der passerer gennem krystaller, genererer et diffraktionsmønster på skærmen (1). Kredit:Elena Khavina/MIPT
Røntgen-frielektronlasere viste sig at være nyttige uden for biologien:I løbet af de sidste år, SFX er blevet brugt mere og mere af fysikere og kemikere, også. Den første enhed blev tilgængelig for eksperimenter i 2009, og nu er der fem centre åbne for forskere i USA, Japan, Sydkorea, Tyskland, og Schweiz. En ny er ved at blive bygget i Kina, og det amerikanske anlæg - historisk set det første - har annonceret planer for modernisering.
Mens den nye teknologi har givet forskerne et indblik i strukturen af proteiner, der tidligere undgik analyse, det har også fremmet nye tekniske og matematiske løsninger. Konventionel røntgenkrystallografi involverer at udsætte én krystal for stråling fra forskellige vinkler og analysere de resulterende diffraktionsmønstre kollektivt. I SFX, krystallen ødelægges øjeblikkeligt af den første interaktion med en kraftig røntgenpuls. Så forskere er nødt til at gentage processen med mange små krystaller og analysere de "serielle" data, der således genereres, deraf navnet på metoden.
En yderligere udfordring er at udvælge prøverne til SFX. I konventionel røntgenkrystallografi, blot at vælge den største og højeste kvalitet krystal var vejen at gå. Dette kan gøres manuelt, ved at se de tilgængelige prøver. Den nye procedure kræver, at man arbejder med en suspension af mange små krystaller af varierende størrelse og kvalitet. Centrifuger og filtre med kendte poredimensioner bruges til at adskille krystallerne efter størrelse.
Metoder til at placere prøver i kammeret skulle uddybes, også. Røntgen-frielektronlasere har en vis maksimal frekvens, ved hvilken de kan udsende strålingsimpulser. For at reducere udgifter og tidsforbrug, nye krystaller skal føres ind i kammeret med samme frekvens. Indtil nu, to tilgange er blevet udviklet til at gøre dette. Under den første, krystallerne kommer ind i kammeret i en flydende suspension, leveres af en injektor. Strålen, der forlader injektoren, "klemmes" af en gasstrøm for at sikre korrekt prøveplacering. Det er, når man passerer igennem, en krystal ender præcis i midten af laserstrålen (fig. 2, venstre). Alternativt proteinkrystallerne kan spredes over et substrat, der er gennemsigtigt for røntgenstråler og automatisk føres ind i laserstrålen før hver puls (fig. 2, ret).
Siden de producerede sine første resultater i 2011, SFX har afsløret over 200 proteinstrukturer. Blandt dem er 51 mål potentielt vigtige for farmakologi - membranreceptorer, gærer, virale proteiner, osv. - som tidligere var utilgængelige for konventionelle analytiske teknikker.
MIPT-teamets systematiske gennemgang af teknologien anvendt til biologi og farmakologi vil uden tvivl hjælpe andre forskere, der søger at opnå strukturerne for vigtige lægemiddelmål for at udvikle ny medicin.
 Varme artikler
Varme artikler
-
 Ny metode til hurtigere og enklere produktion af lipiderede proteinerI Journal of the American Chemical Society, forskere fra Graz University of Technology og University of Wien præsenterer en ny metode til produktion af lipidproteiner. Sammenlignet med etablerede meto
Ny metode til hurtigere og enklere produktion af lipiderede proteinerI Journal of the American Chemical Society, forskere fra Graz University of Technology og University of Wien præsenterer en ny metode til produktion af lipidproteiner. Sammenlignet med etablerede meto -
 Elektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentialeElektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentiale. Indsat viser den cryo-EM-afledte struktur af en AAV2. Det fulde billede viser den eksperimentelt bestemte tæthed (grå) og
Elektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentialeElektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentiale. Indsat viser den cryo-EM-afledte struktur af en AAV2. Det fulde billede viser den eksperimentelt bestemte tæthed (grå) og -
 Forskere udvikler nanoporøs super-multi-element katalysatorKredit:Japan Science and Technology Agency (JST) En fælles forskergruppe ledet af forskningsassistent Cai ZeXing og professor Takeshi Fujita ved School of Environmental Science and Engineering, Ko
Forskere udvikler nanoporøs super-multi-element katalysatorKredit:Japan Science and Technology Agency (JST) En fælles forskergruppe ledet af forskningsassistent Cai ZeXing og professor Takeshi Fujita ved School of Environmental Science and Engineering, Ko -
 Hvordan holder muskel- og seneforbindelser hele livet?Skær i længderetningen gennem thoraxen på en frugtflue med en indsat kraftsensor i talinproteinet. Kraftsensoren på muskel-seneforbindelserne er grøn, og flyvemusklerne er magenta. Kredit:S. Lemke et
Hvordan holder muskel- og seneforbindelser hele livet?Skær i længderetningen gennem thoraxen på en frugtflue med en indsat kraftsensor i talinproteinet. Kraftsensoren på muskel-seneforbindelserne er grøn, og flyvemusklerne er magenta. Kredit:S. Lemke et
- Hvad er forskellen mellem endelig matematik og forudregning?
- Hvordan at arbejde væk er at ændre hjem
- Forskere opfandt metode til at fange bakterier med fotonisk krog
- Fantastiske,
- Få mest muligt ud af spinat - maksimering af antioxidanten lutein
- Molekylært stillads til modificering af fluorescerende forbindelser, der anvendes til biologisk bil…


