Hvordan fremskynder man metals reaktion med luft?
1. Forøg overfladearealet :Jo større overfladeareal af metallet, der udsættes for luft, jo hurtigere vil reaktionen ske. Dette er grunden til, at findelte metaller, såsom pulvere, reagerer hurtigere end faste blokke af samme metal. Slibning, slibning eller på anden måde ru på metallets overflade kan øge dets reaktivitet.
2. Temperatur :Højere temperaturer øger generelt hastigheden af kemiske reaktioner, og reaktionen mellem metal og luft er ingen undtagelse. Når temperaturen stiger, bliver metalatomerne mere energiske og mobile, hvilket letter deres interaktion med iltmolekyler i luften.
3. Fugtighed :Tilstedeværelsen af fugt eller fugt i luften kan fremskynde korrosionsprocessen betydeligt. Vanddamp fungerer som en elektrolyt, der tillader ioner at bevæge sig og letter de elektrokemiske reaktioner, der er involveret i korrosion.
4. Saltholdighed :Metaller udsat for saltvand eller miljøer med høje saltkoncentrationer oplever accelereret korrosion på grund af tilstedeværelsen af chloridioner. Disse ioner fremmer nedbrydningen af det beskyttende oxidlag på metallets overflade, hvilket gør det mere sårbart over for yderligere oxidation.
5. Surhed :Sure miljøer, såsom dem, der indeholder saltsyre eller svovlsyre, kan hurtigt korrodere metaller. Hydrogenioner til stede i sure opløsninger angriber metallet, hvilket fører til dannelse af metalioner og frigivelse af brintgas.
6. Oxidationsmidler :Tilstedeværelsen af stærke oxidationsmidler, såsom hydrogenperoxid eller salpetersyre, kan i høj grad øge metaloxidationshastigheden. Disse stoffer donerer let ilt til metaloverfladen, hvilket fremskynder korrosionsprocessen.
7. Mekanisk stress :Påføring af mekanisk belastning på et metal kan også øge dets modtagelighed for korrosion. Når et metal udsættes for belastning eller deformation, kan det føre til dannelse af revner eller defekter, hvilket giver veje for korrosive stoffer til at trænge ind og reagere med metallet.
8. Elektrokemiske reaktioner :Visse metaller kan gennemgå galvanisk korrosion, når de kommer i kontakt med uens metaller i nærværelse af en elektrolyt (f.eks. saltvand). Denne proces involverer overførsel af elektroner mellem metallerne, hvilket fører til den accelererede korrosion af det mindre ædle metal.
Ved at forstå og kontrollere disse faktorer er det muligt at manipulere hastigheden af metalkorrosion eller oxidation til forskellige praktiske anvendelser, såsom i metallurgi, korrosionsbeskyttelse og design af materialer til specifikke miljøer.
 Varme artikler
Varme artikler
-
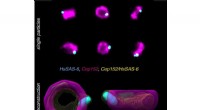 Superopløsningsmikroskopi bygger flerfarvet 3-D fra 2-DHumane centrioler mærket med antistoffer mod to proteiner (Cep152, HsSAS-6) og afbildet ved hjælp af superopløsningsmikroskopi. Fra mange individuelle partikler, der viser projektioner af centriolkomp
Superopløsningsmikroskopi bygger flerfarvet 3-D fra 2-DHumane centrioler mærket med antistoffer mod to proteiner (Cep152, HsSAS-6) og afbildet ved hjælp af superopløsningsmikroskopi. Fra mange individuelle partikler, der viser projektioner af centriolkomp -
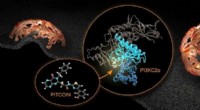 Inhibitor af lipidkinase PI3KC2a identificeret som potentiel ny behandling af tromboseKredit:Barth van Rossum Lipidkinasen PI3KC2a er et potentielt farmakologisk mål til behandling af trombose og muligvis cancer. Forskere fra Leibniz-Forschungsinstitut für Molekulare Pharmakologie (
Inhibitor af lipidkinase PI3KC2a identificeret som potentiel ny behandling af tromboseKredit:Barth van Rossum Lipidkinasen PI3KC2a er et potentielt farmakologisk mål til behandling af trombose og muligvis cancer. Forskere fra Leibniz-Forschungsinstitut für Molekulare Pharmakologie ( -
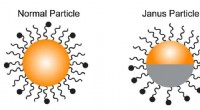 Kemikere skaber en kemisk sonde for bedre at forstå immunresponsOpkaldt efter den to-ansigtede romerske gud, en Janus partikel, ret, er belagt med to separate molekyletyper på tværs af overfladen. Kredit:Lucy Sanchez En trio af kemikere ved Indiana University
Kemikere skaber en kemisk sonde for bedre at forstå immunresponsOpkaldt efter den to-ansigtede romerske gud, en Janus partikel, ret, er belagt med to separate molekyletyper på tværs af overfladen. Kredit:Lucy Sanchez En trio af kemikere ved Indiana University -
 Nyopdagede hybridmolekyler kunne tjene som en ny kategori af anti-cancermiddelEn skematisk fremstilling af virkningsmekanismen for de metalorganiske trefoil-knuder. Internaliseret via aktiv mekanisme, i det sure miljø af kræftceller, knuderne falder fra hinanden og udløser toks
Nyopdagede hybridmolekyler kunne tjene som en ny kategori af anti-cancermiddelEn skematisk fremstilling af virkningsmekanismen for de metalorganiske trefoil-knuder. Internaliseret via aktiv mekanisme, i det sure miljø af kræftceller, knuderne falder fra hinanden og udløser toks
- Forskere afslører, hvorfor nanotråde klæber til hinanden
- Foretrækker forbrugerne mærker, der vises på deres Facebook-sider?
- Internettet:Netneutralitet diskriminerende?
- Hvordan næsten identiske RNA-helikaser driver 'mRNA-eksport' via forskellige proteinkompleks-veje
- Ny onlineversion af den kinesiske intoleranceusikkerhedsskala – er den gyldig?
- Koncertøkonomien kan styrke den usynlige fordel, mænd har på arbejdet


