Hvad er forskellen mellem smeltning og fordampning?
* Smeltning opstår, når et fast stof ændres til en væske. Dette sker, når temperaturen af det faste stof hæves, indtil det når sit smeltepunkt. Smeltepunktet er den temperatur, hvor de faste og flydende faser er i ligevægt, hvilket betyder, at de kan eksistere side om side. Når smeltepunktet er nået, vil det faste stof begynde at smelte og blive til en væske.
* Fordampning opstår, når en væske ændres til en gas. Dette sker, når væskens temperatur hæves, indtil den når kogepunktet. Kogepunktet er den temperatur, ved hvilken væskens damptryk er lig med trykket i den omgivende atmosfære. Når kogepunktet er nået, vil væsken begynde at fordampe og blive til en gas.
Den største forskel mellem smeltning og fordampning er den faseændring, der sker. Smeltning involverer en ændring fra et fast stof til en væske, mens fordampning involverer en ændring fra en væske til en gas.
En anden forskel mellem smeltning og fordampning er mængden af energi, der kræves. Afsmeltning kræver mindre energi end fordampning. Dette skyldes, at molekylerne i et fast stof er tættere pakket sammen end molekylerne i en væske. Derfor kræver det mindre energi at bryde bindingerne mellem molekylerne i et fast stof og få dem til at bevæge sig fra hinanden til en flydende fase.
Endelig sker smeltning og fordampning ved forskellige temperaturer. Smeltning sker ved et stofs smeltepunkt, mens fordampning sker ved et stofs kogepunkt. Et stofs smeltepunkt og kogepunkt er forskellige, og de afhænger af stoffets kemiske sammensætning og tryk.
Her er en tabel, der opsummerer de vigtigste forskelle mellem smeltning og fordampning:
| Ejendom | Smeltning | Fordampning |
|---|---|---|
| Faseændring | Fast til flydende | Væske til gas |
| Kræver energi | Mindre | Mere |
| Temperatur | Smeltepunkt | Kogepunkt |
Sidste artikelReagerer jod i saltsyreopløsning?
Næste artikelTemperatur, hvor en gas bliver flydende?
 Varme artikler
Varme artikler
-
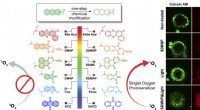 Lab forvandler fluorescerende mærker til kræftdrabereDesignet af thio-baserede fotosensibilisatorer, til venstre, af Rice University viser kemikere løfte om fotodynamisk kræftbehandling, blandt andre applikationer. En thiocarbonylsubstitution - handel m
Lab forvandler fluorescerende mærker til kræftdrabereDesignet af thio-baserede fotosensibilisatorer, til venstre, af Rice University viser kemikere løfte om fotodynamisk kræftbehandling, blandt andre applikationer. En thiocarbonylsubstitution - handel m -
 Forskere bruger kunstig intelligens til at plotte grøn rute til nylonMiguel Modestino, professor i kemisk biomolekylær teknik og Danela Blanco, en ph.d. elevpose med reaktor til organisk elektrokemi. Kredit:NYU Tandon School of Engineering Den kemiske og beslægtede
Forskere bruger kunstig intelligens til at plotte grøn rute til nylonMiguel Modestino, professor i kemisk biomolekylær teknik og Danela Blanco, en ph.d. elevpose med reaktor til organisk elektrokemi. Kredit:NYU Tandon School of Engineering Den kemiske og beslægtede -
 Forskere fanger roaming molekylære fragmenter i realtidKredit:Pixabay/CC0 Public Domain Observation af en kemisk reaktion på molekylært niveau i realtid er et centralt tema i eksperimentel kemisk fysik. Et internationalt forskerhold har for første gan
Forskere fanger roaming molekylære fragmenter i realtidKredit:Pixabay/CC0 Public Domain Observation af en kemisk reaktion på molekylært niveau i realtid er et centralt tema i eksperimentel kemisk fysik. Et internationalt forskerhold har for første gan -
 Forskere kortlægger tendenser inden for lægemiddeludviklingKredit:Københavns Universitet Fra et narkotikaperspektiv, G-proteinkoblede receptorer er de mest anvendte cellereceptorer i kroppen. De er unikt tilgængelige på celleoverfladen, og en tredjedel af
Forskere kortlægger tendenser inden for lægemiddeludviklingKredit:Københavns Universitet Fra et narkotikaperspektiv, G-proteinkoblede receptorer er de mest anvendte cellereceptorer i kroppen. De er unikt tilgængelige på celleoverfladen, og en tredjedel af
- En kamp om jetstrømmen raser over vores hoveder
- Ektopiske øjne fungerer uden forbindelse til hjernen:Eksperimenter med haletudser viser ektopisk, d…
- Forskere finder, at landskabsrygge kan holde spor om istid og klimaforandringer
- Forskere fløj det i at efterligne evolution for at finde den bedste flyform
- Hvilket materiale er i stand til så hurtig nedbrydning, at en enorm energi frigives praktisk talt ø…
- Forskere observerer ultrahurtig fødsel af radikaler


