Hvad gør natrium i vand?
Reaktionen mellem natrium og vand kan repræsenteres ved følgende kemiske ligning:
2Na(s) + 2H2O(l) → 2NaOH(vandig) + H2(g)
I denne ligning:
- Na(s) repræsenterer fast natrium.
- H2O(l) repræsenterer flydende vand.
- NaOH(aq) repræsenterer natriumhydroxid, som dannes som et produkt af reaktionen og opløses i vand for at danne en basisk opløsning.
- H2(g) repræsenterer brintgas, som også er et produkt af reaktionen og frigives som en gas.
Under reaktionen mister natriumatomerne i metallet hurtigt deres yderste elektron og bliver til positivt ladede natriumioner (Na+). Disse natriumioner tiltrækkes af de negativt ladede oxygenatomer i vandmolekylerne og danner kemiske bindinger og resulterer i dannelsen af natriumhydroxid (NaOH).
Samtidig får brintatomerne i vandmolekylerne de elektroner, der tabes af natrium, og bliver til neutrale brintatomer. Disse brintatomer kombineres derefter og danner brintgas (H2), som frigives som bobler til den omgivende atmosfære.
Natrium-vand-reaktionen er meget eksoterm, hvilket betyder, at den frigiver en betydelig mængde varme. Den frigjorte varme kan få vandet til at koge hurtigt og generere damp. Reaktionen kan også være ledsaget af flammer og gnister på grund af den høje temperatur og frigivelsen af brintgas, som er brandfarlig.
På grund af dets meget reaktive karakter skal natrium håndteres med forsigtighed, især i nærværelse af vand. Det er vigtigt at opbevare natrium i et tørt miljø og undgå direkte kontakt med vand for at forhindre forekomsten af en potentielt farlig reaktion.
Sidste artikelHvor mange atomer i molekylet ph3?
Næste artikelHvilke næringsstoffer indeholder kun brint og ilt?
 Varme artikler
Varme artikler
-
 Video:Fremtiden for solcreme begynder med blæksprutteKredit:CC0 Public Domain Pigmenterne i huden på blæksprutter, herunder blæksprutter, blæksprutte, og blæksprutte, kan absorbere ultraviolet stråling. Forskere i Northeasterns Biomaterials Design
Video:Fremtiden for solcreme begynder med blæksprutteKredit:CC0 Public Domain Pigmenterne i huden på blæksprutter, herunder blæksprutter, blæksprutte, og blæksprutte, kan absorbere ultraviolet stråling. Forskere i Northeasterns Biomaterials Design -
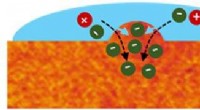 For at forbinde biologi med elektronik, være stiv, alligevel fleksibelEt skematisk billede af P3HT-filmen, viser områder, der er i stand til subtilt at svulme op for at lukke ionmolekyler ind. Kredit:Rajiv Giridharagopal Problemet er en grundlæggende uforenelighed i
For at forbinde biologi med elektronik, være stiv, alligevel fleksibelEt skematisk billede af P3HT-filmen, viser områder, der er i stand til subtilt at svulme op for at lukke ionmolekyler ind. Kredit:Rajiv Giridharagopal Problemet er en grundlæggende uforenelighed i -
 VCU-opfindernes håndholdte enhed bringer enorme forbedringer til vandtestprocessenPrototype af Tepper og Dodds patenterede håndholdte urandetektionsenhed; komponenter (fra venstre):pumpe, silica kammer, breadboard kredsløb Kredit:VCU School of Engineering Forhøjede niveauer af
VCU-opfindernes håndholdte enhed bringer enorme forbedringer til vandtestprocessenPrototype af Tepper og Dodds patenterede håndholdte urandetektionsenhed; komponenter (fra venstre):pumpe, silica kammer, breadboard kredsløb Kredit:VCU School of Engineering Forhøjede niveauer af -
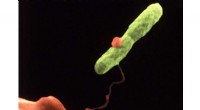 Nye test identificerer forurenet drikkevand på få minutter, ikke ugerLegionellaceller kan påvises med en testmaskine i hjemmeprinterstørrelse. Kredit:CDC/ Dr. Barry S. Fields Hurtig, overkommelige vandtest, der kan bruges på stedet og endda køre kontinuerligt, vil
Nye test identificerer forurenet drikkevand på få minutter, ikke ugerLegionellaceller kan påvises med en testmaskine i hjemmeprinterstørrelse. Kredit:CDC/ Dr. Barry S. Fields Hurtig, overkommelige vandtest, der kan bruges på stedet og endda køre kontinuerligt, vil


