Hvad er definitionerne af begrænsende reaktant i kemi?
1. Fuldstændig forbrug: Den begrænsende reaktant er den reaktant, der bliver fuldstændig brugt op under reaktionen, og dermed kontrollerer den maksimale mængde produkt, der kan opnås. Når først den begrænsende reaktant er opbrugt, stopper reaktionen, selvom der er overskud af andre reaktanter til stede.
2. Balanceret kemisk ligning: De støkiometriske koefficienter i en afbalanceret kemisk ligning angiver de molforhold, hvori reaktanter kombineres for at danne produkter. Ud fra disse molforhold kan vi bestemme den kvantitative sammenhæng mellem
nødvendige reaktanter for at reaktionen kan forløbe uden at efterlade noget overskud.
Eksempel :Overvej den afbalancerede kemiske ligning for forbrænding af metan
```
CH4 + 2O2 -> CO2 + 2H2O
```
Hvis vi starter med 2 mol CH4 og 8 mol O2, er det vigtigt at finde ud af, hvilken reaktant der vil blive fuldstændig forbrugt og fungere som det begrænsende reagens:
- For CH4:
Molforhold =mol CH4 / støkiometrisk koefficient for CH4
=2 mol / 1 =2:1
Dette forhold indebærer, at for hver 1 mol CH4 skal vi bruge 2 mol O2 for at reagere.
- For O2:
Molforhold =mol O2 / støkiometrisk koefficient for O2
=8 mol / 2 =4:1
Dette forhold antyder, at for hver 1 mol CH4 skal vi bruge 2 mol O2 for at reagere. Ved at sammenligne molforholdene finder vi, at CH4 har et lavere molforhold (2:1) sammenlignet med O2 (4:1). Med andre ord, for hver 1 mol CH4 har vi kun brug for 2 mol O2, men vi har overskydende O2 (8 mol), som vil forblive ureageret efter CH4 er opbrugt. CH4 vil reagere fuldstændigt først, hvilket gør den til den begrænsende reaktant. Derfor vil den maksimale mængde produkt (CO2 og H2O), der kan dannes, blive bestemt af mængden af CH4, der er tilgængelig i systemet. Identifikation af den begrænsende reaktant er afgørende for nøjagtige støkiometriske beregninger og for at optimere effektiviteten af kemiske reaktioner.
 Varme artikler
Varme artikler
-
 Dyrkning af polymerer med forskellige længderSymbolsk repræsentation af, hvordan spredningen af et plastik kan kontrolleres ved at blande to katalysatorer (malerør). Kredit:Whitfield R et al, Chem, 2020 ETH-forskere har udviklet en ny meto
Dyrkning af polymerer med forskellige længderSymbolsk repræsentation af, hvordan spredningen af et plastik kan kontrolleres ved at blande to katalysatorer (malerør). Kredit:Whitfield R et al, Chem, 2020 ETH-forskere har udviklet en ny meto -
 Fremtiden for cellekultur:En ny kontinuerlig bioproces udvikletSammenligning af den nye overflade til celleproduktion med glasskiven, der producerer den samme mængde celler som 14 traditionelle kolber. Kredit:Newcastle University, Storbritannien En teknik, de
Fremtiden for cellekultur:En ny kontinuerlig bioproces udvikletSammenligning af den nye overflade til celleproduktion med glasskiven, der producerer den samme mængde celler som 14 traditionelle kolber. Kredit:Newcastle University, Storbritannien En teknik, de -
 Små elektriske felter kan spille en afgørende rolle i dannelsen af diamantDiamant produceret under højt tryk og ekstra spænding. Kredit:Yuliya Bataleva Diamant, som grafit, er en særlig form for kulstof. Dens kubiske krystalstruktur og dens stærke kemiske bindinger give
Små elektriske felter kan spille en afgørende rolle i dannelsen af diamantDiamant produceret under højt tryk og ekstra spænding. Kredit:Yuliya Bataleva Diamant, som grafit, er en særlig form for kulstof. Dens kubiske krystalstruktur og dens stærke kemiske bindinger give -
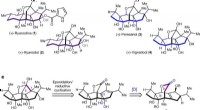 Kemikere syntetiserer perseanol for første gangen, Kemisk struktur, kulstofnummerering og ringsystembogstav tildeling for ryanodane (a) og isoryanodane (b) diterpener. c, Retrosyntetisk analyse af isoryanodane diterpen (+)-perseanol. [O], oxidatio
Kemikere syntetiserer perseanol for første gangen, Kemisk struktur, kulstofnummerering og ringsystembogstav tildeling for ryanodane (a) og isoryanodane (b) diterpener. c, Retrosyntetisk analyse af isoryanodane diterpen (+)-perseanol. [O], oxidatio
- Klarere, hurtigere, glattere:Forbedring af onlinevideoafspilning på mobilnetværk
- I det første, forskere måler præcist, hvordan syntetiske diamanter vokser
- Ser tilbage på 250 års tørke på den koreanske halvø
- Singapore siger, at hackere stjal 1,5 millioner helbredsjournaler i rekordstore cyberangreb
- Ingeniører løser katalyse vs korrosionsmysterium i elektrokemisk ozonproduktion
- Sådan beregnes Coulombs


