Hvad er den begrænsende reaktant, når masser af reaktanter er ens?
Overvej for eksempel reaktionen mellem hydrogen (H2) og oxygen (O2) for at danne vand (H2O):
2H2 + O2 -> 2H20
Hvis vi har 1 mol H2 og 1 mol O2, kan vi beregne mol vand produceret af hver reaktant ved hjælp af deres støkiometriske koefficienter:
Mol H2O fra H2 =1 mol H2 * (2 mol H2O / 2 mol H2) =1 mol H2O
Mol H2O fra O2 =1 mol O2 * (2 mol H2O / 1 mol O2) =2 mol H2O
I dette tilfælde producerer O2 flere mol vand (2 mol) sammenlignet med H2 (1 mol). Derfor er H2 den begrænsende reaktant, fordi den producerer en mindre mængde vand.
Så når masserne af reaktanter er de samme, er den begrænsende reaktant den, der producerer færre mol af produkter baseret på støkiometrien af den afbalancerede kemiske ligning.
Sidste artikelSkaber mælk og eddike en kemisk reaktion?
Næste artikelHvad er definitionerne af begrænsende reaktant i kemi?
 Varme artikler
Varme artikler
-
 Kollektiv adskillelse af sammenfiltrede polymererEt aktin filament i bevægelse. Kredit:C. Hohmann, NIM LMU-forskere har modbevist den konventionelle teori, der bruges til at forklare dynamikken i polymerløsninger. De viser, at for biopolymerer f
Kollektiv adskillelse af sammenfiltrede polymererEt aktin filament i bevægelse. Kredit:C. Hohmann, NIM LMU-forskere har modbevist den konventionelle teori, der bruges til at forklare dynamikken i polymerløsninger. De viser, at for biopolymerer f -
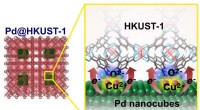 Grænseflade elektronisk tilstand, der forbedrer brintlagringskapacitet i Pd-MOF-materialer(Venstre) Struktur af en Pd@HKUST-1. (Højre) Skematisk diagram, der illustrerer overførslen af elektrisk ladning fra en Pd nanocube til HKUST-1 MOFer (metal-organiske rammer) Kredit:NIMS NIMS, K
Grænseflade elektronisk tilstand, der forbedrer brintlagringskapacitet i Pd-MOF-materialer(Venstre) Struktur af en Pd@HKUST-1. (Højre) Skematisk diagram, der illustrerer overførslen af elektrisk ladning fra en Pd nanocube til HKUST-1 MOFer (metal-organiske rammer) Kredit:NIMS NIMS, K -
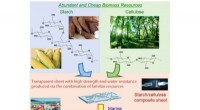 Forskere skaber vandnedbrydelig plast, der kombinerer stivelse og celluloseFig. 1. Marine bionedbrydeligt plastpræparat fra stivelse og cellulose. Kredit:Osaka University Hovedårsagen til akkumulering af havaffald er dumpning af plastikaffald i havene, da det meste plast
Forskere skaber vandnedbrydelig plast, der kombinerer stivelse og celluloseFig. 1. Marine bionedbrydeligt plastpræparat fra stivelse og cellulose. Kredit:Osaka University Hovedårsagen til akkumulering af havaffald er dumpning af plastikaffald i havene, da det meste plast -
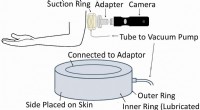 Ny enhed kan hjælpe med at minimere ardannelse ved kosmetisk kirurgiSkematisk af den nye enhed, der kan fastslå orienteringen af hudspændingslinjer. Kredit:Guy German Forskere ved Binghamton University, State University of New York har udviklet en ny enhed, der
Ny enhed kan hjælpe med at minimere ardannelse ved kosmetisk kirurgiSkematisk af den nye enhed, der kan fastslå orienteringen af hudspændingslinjer. Kredit:Guy German Forskere ved Binghamton University, State University of New York har udviklet en ny enhed, der
- Brug af kunstig intelligens til at forbedre satellitbilleder til at overvåge planeten
- Brug af spejle til at forbedre kvaliteten af lyspartikler
- Naturbrande raserer snesevis af hjem i New Zealand
- Geofysikere og atmosfæriske forskere samarbejder om at spore tyfoners seismiske fodspor
- Palau planlægger et forbud mod solcreme for at redde koraller
- Ørken:udtørring af Eufrat truer med katastrofe i Syrien


