Hvad sker der med et atom, når det har flere elektroner end protoner?
Her er hvad der sker med et atom med flere elektroner end protoner:
1. Forstærkning af elektroner:
Når et atom får flere elektroner end dets antal protoner, opvejer den negative ladning af de ekstra elektroner protonernes positive ladning. Atomet får en samlet negativ ladning og omdannes til en negativt ladet ion.
2. Dannelse af ioniske bindinger:
For at opnå en stabil konfiguration og elektrisk neutralitet har det negativt ladede atom en tendens til at binde med positivt ladede atomer eller ioner for at danne en ionisk forbindelse. For eksempel, hvis klor (Cl) får en elektron, bliver det Cl-, som derefter kan binde sig til natrium (Na+) og danne en ionisk forbindelse som natriumchlorid (NaCl).
3. Valenselektroner:
De ekstra elektroner, som atomet opnår, fylder det yderste energiniveau, kendt som valensskallen. Disse opnåede elektroner er kendt som valenselektroner, og deres arrangement og antal spiller en afgørende rolle for atomets kemiske egenskaber og bindingsadfærd.
4. Anioniske egenskaber:
De overskydende elektroner i et atom giver det anioniske egenskaber, såsom:
- Stærk tiltrækning af positivt ladede ioner eller atomer.
- Dannelse af ionbindinger gennem elektrostatisk tiltrækning.
- Lavere ioniseringsenergi sammenlignet med neutrale atomer.
- Højere elektronaffinitet på grund af det øgede antal elektroner.
- Forskellig kemisk reaktivitet sammenlignet med neutrale atomer.
Det er værd at bemærke, at atomer har tendens til at vinde eller miste elektroner for at opnå en stabil elektronkonfiguration, ofte efter oktetreglen (hvor atomer sigter mod at have otte valenselektroner). Forstærkningen af elektroner og efterfølgende anioniske egenskaber spiller væsentlige roller i forskellige kemiske processer, herunder saltdannelse, elektrostatiske interaktioner og dannelsen af ioniske gitter i forbindelser.
Sidste artikelhvor er positionen af antal ioner placeret i en ionformel?
Næste artikeløger eller sænker faststof til gas temperaturen?
 Varme artikler
Varme artikler
-
 Muslinge-inspireret lim kunne en dag gøre fosteroperation mere sikkerEn lim baseret på en muslingeklæber er stærk nok til at suspendere en pose skaldyr. Kredit:Diederik Balkenende Om man skal operere et foster, er en hjerteskærende beslutning. Denne type operation
Muslinge-inspireret lim kunne en dag gøre fosteroperation mere sikkerEn lim baseret på en muslingeklæber er stærk nok til at suspendere en pose skaldyr. Kredit:Diederik Balkenende Om man skal operere et foster, er en hjerteskærende beslutning. Denne type operation -
 Robotter aktiveret af vand kan være den næste grænseNy forskning fra laboratoriet i Ozgur Sahin, lektor i biologiske videnskaber og fysik ved Columbia University, viser, at materialer kan fremstilles til at skabe bløde aktuatorer - enheder, der konvert
Robotter aktiveret af vand kan være den næste grænseNy forskning fra laboratoriet i Ozgur Sahin, lektor i biologiske videnskaber og fysik ved Columbia University, viser, at materialer kan fremstilles til at skabe bløde aktuatorer - enheder, der konvert -
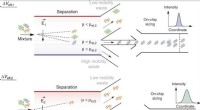 Mikrofluidik:2-D fingeraftryk af heterogene proteiner i opløsningOn-chip separation og analyse af blandinger i væskefase. Ved at justere den effektive spænding, Δveff, molekyler med en specifik elektroforetisk mobilitet, μ = μel, og dermed et specifikt forhold mell
Mikrofluidik:2-D fingeraftryk af heterogene proteiner i opløsningOn-chip separation og analyse af blandinger i væskefase. Ved at justere den effektive spænding, Δveff, molekyler med en specifik elektroforetisk mobilitet, μ = μel, og dermed et specifikt forhold mell -
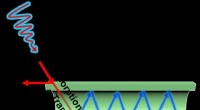 Tuning rør for bedre katalysatorerAbsorberet lys spredes gennem et titaniumoxid fotokatalytisk rør. Kredit:University of Southern Queensland 2020 Titandioxid (TiO 2 ) har betydelig kraft som fotokatalysator - et materiale, der f
Tuning rør for bedre katalysatorerAbsorberet lys spredes gennem et titaniumoxid fotokatalytisk rør. Kredit:University of Southern Queensland 2020 Titandioxid (TiO 2 ) har betydelig kraft som fotokatalysator - et materiale, der f
- Konvertering af sollys til brændstof:Udvikling af mere effektive fotokatoder
- Forskere leverer kvantealgoritmer til at udvikle nye materialer og kemi
- Robotisk samling af verdens mindste hus - selv en mide passer ikke ind ad døren
- Hvor 'klæbrig' er tæt nukleart stof?
- Udnyttelse af potentialet i sociale medier og crowdsourcing til bedre katastrofemodstandsdygtighed i…
- Grafennøgle til ny hardwaresikkerhed


