Hvorfor deler atomer forstærkning eller taber elektroner?
Når atomer deler elektroner, danner de kovalente bindinger. I en kovalent binding deler to atomer et eller flere elektronpar. Denne deling af elektroner gør det muligt for begge atomer at opnå en stabil elektronkonfiguration. For eksempel, når to brintatomer bindes til et brintmolekyle, deler hvert brintatom en elektron med det andet brintatom. Dette resulterer i, at begge brintatomer har en fuld ydre elektronskal, hvilket gør brintmolekylet stabilt.
Når atomer får eller mister elektroner, danner de ionbindinger. I en ionbinding overfører et atom en eller flere elektroner til et andet atom. Dette resulterer i, at det ene atom har en positiv ladning (en kation) og det andet atom har en negativ ladning (en anion). Den elektrostatiske tiltrækning mellem de positive og negative ladninger holder ionerne sammen. For eksempel, når natrium- og kloratomer bindes til natriumchlorid, mister natriumatomet en elektron til kloratomet. Dette resulterer i, at natriumatomet har en positiv ladning og chloratomet har en negativ ladning. Den elektrostatiske tiltrækning mellem natrium- og klorionerne holder natriumchloridkrystallen sammen.
Generelt vil atomer dele, vinde eller miste elektroner for at opnå en stabil elektronkonfiguration. Dette skyldes, at en stabil elektronkonfiguration gør et atom mere kemisk inert og mindre tilbøjelige til at reagere med andre atomer.
Sidste artikelHvorfor danner brom en -1-ion?
Næste artikelHar brom tendens til at reagere ved at få elektroner?
 Varme artikler
Varme artikler
-
 Flydende celler i en bølget mikrokanal til effektiv størrelsesbaseret cellesorteringSkematisk af størrelsesbaseret inerticellesortering i en bølgekanalenhed før det trifurcerede output. Forskellige størrelse biologiske celler kan opnå distinkt fokuseringsadfærd, som således resultere
Flydende celler i en bølget mikrokanal til effektiv størrelsesbaseret cellesorteringSkematisk af størrelsesbaseret inerticellesortering i en bølgekanalenhed før det trifurcerede output. Forskellige størrelse biologiske celler kan opnå distinkt fokuseringsadfærd, som således resultere -
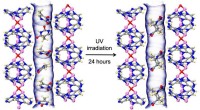 Ny biologisk afledt metal-organisk ramme efterligner DNASION-19, en biologisk afledt MOF baseret på adenin blev brugt til at låse Thymin (Thy) molekyler i kanalerne gennem hydrogenbindingsinteraktioner mellem adenin og thymin. Ved bestråling, thyminmolekyl
Ny biologisk afledt metal-organisk ramme efterligner DNASION-19, en biologisk afledt MOF baseret på adenin blev brugt til at låse Thymin (Thy) molekyler i kanalerne gennem hydrogenbindingsinteraktioner mellem adenin og thymin. Ved bestråling, thyminmolekyl -
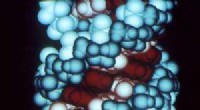 Annotationsværktøj giver et skridt i retning af at forstå sammenhænge mellem sygdom, mutant RNADette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia Forskere ved Oregon State University har udviklet et computerprogram, der repræsenterer et vigtigt skridt mod bedre
Annotationsværktøj giver et skridt i retning af at forstå sammenhænge mellem sygdom, mutant RNADette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia Forskere ved Oregon State University har udviklet et computerprogram, der repræsenterer et vigtigt skridt mod bedre -
 Forskere kaster nyt lys over påvisning af influenzaVirale kulturer er guldstandarden for diagnosticering af influenza, men det tager flere dage at udvikle sig. Ved at målrette et enzym, der er iboende for virussen og identificere dets tilstedeværelse
Forskere kaster nyt lys over påvisning af influenzaVirale kulturer er guldstandarden for diagnosticering af influenza, men det tager flere dage at udvikle sig. Ved at målrette et enzym, der er iboende for virussen og identificere dets tilstedeværelse
- Crew-7-astronauter forlader ISS efter næsten 200 dage i rummet
- Borgerforskere kan være en uudnyttet ressource til forbedring af vandkvaliteten
- Forskere udvikler en kompositmembran til zinkbaserede strømbatterier med lang levetid
- Nasas Rossi X-ray Timing Explorer efterlader videnskabelig arv
- Ny strategi afslører den fulde kemiske kompleksitet af kvantedekohærens
- Hvis du fortynder eddike, hvordan påvirker det pH-værdien?


