Har isopropylalkohol en større intermolekylær kraft end vand?
Forklaring:
De intermolekylære kræfter i en forbindelse afhænger af molekylernes polaritet og deres evne til at danne brintbindinger.
Vand:
- Vandmolekyler er polære, hvilket betyder, at de har en delvis positiv ladning på brintatomerne og en delvis negativ ladning på iltatomet.
- Denne polaritet gør det muligt for vandmolekyler at danne stærke brintbindinger med hinanden. Hydrogenbindinger er intermolekylære kræfter, der dannes, når et brintatom kovalent bundet til et meget elektronegativt atom (såsom oxygen, nitrogen eller fluor) oplever elektrostatisk tiltrækning til et andet elektronegativt atom.
Isopropanol:
- Isopropanolmolekyler er også polære, men i mindre grad end vandmolekyler.
- Tilstedeværelsen af kulbrintegruppen (-CH(CH3)2) i isopropanol reducerer molekylets polaritet sammenlignet med vand.
- Derudover kan isopropanol danne brintbindinger, men hydrogenbindingsevnen er svagere end i vand på grund af den lavere elektronegativitet af oxygenatomet i isopropanol sammenlignet med vand.
Derfor har vand stærkere intermolekylære kræfter på grund af dets højere polaritet og stærkere hydrogenbindingsevne sammenlignet med isopropanol.
Sidste artikelEt aldehyd danner en carboxylsyre ved?
Næste artikelHvad er de almindelige anvendelser af titanium?
 Varme artikler
Varme artikler
-
 En ny idé forbinder syntesen af ler og stofskiftets oprindelseIllustration, der forbinder syntesen af lerarter og metabolismens oprindelse. Kredit:Ruixin Zhou Spørgsmålet om, hvordan livet er begyndt, har fascineret forskere fra mange discipliner, og det v
En ny idé forbinder syntesen af ler og stofskiftets oprindelseIllustration, der forbinder syntesen af lerarter og metabolismens oprindelse. Kredit:Ruixin Zhou Spørgsmålet om, hvordan livet er begyndt, har fascineret forskere fra mange discipliner, og det v -
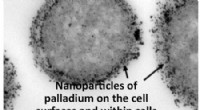 Forskere identificerer billigere, grønnere katalysator til behandling af biobrændstofferEt mikrofotografi af palladium- og bakteriekatalysatoren. Kredit:Lynne Macaskie Brændstoffer, der er produceret fra ikke-råoliebaserede biologiske kilder, kan blive grønnere og mere overkommelige,
Forskere identificerer billigere, grønnere katalysator til behandling af biobrændstofferEt mikrofotografi af palladium- og bakteriekatalysatoren. Kredit:Lynne Macaskie Brændstoffer, der er produceret fra ikke-råoliebaserede biologiske kilder, kan blive grønnere og mere overkommelige, -
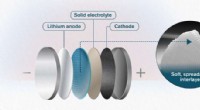 Et smørbart mellemlag kunne gøre solid state-batterier mere stabileSolid state-batterier er af stor interesse for elbilindustrien. Forskere ved Chalmers Tekniske Universitet, Sverige, og Xian Jiaotong University, Kina præsenterer nu en ny måde at bringe dette lovende
Et smørbart mellemlag kunne gøre solid state-batterier mere stabileSolid state-batterier er af stor interesse for elbilindustrien. Forskere ved Chalmers Tekniske Universitet, Sverige, og Xian Jiaotong University, Kina præsenterer nu en ny måde at bringe dette lovende -
 Dyb læring muliggør tidlig påvisning og klassificering af levende bakterier ved hjælp af hologra…Dyb læringsbaseret tidlig påvisning og klassificering af levende bakterier. en, Skematisk af enheden. b, Helpladebillede af E. coli og K. aerogenes kolonier. c, Eksempelbilleder af de individuelle vok
Dyb læring muliggør tidlig påvisning og klassificering af levende bakterier ved hjælp af hologra…Dyb læringsbaseret tidlig påvisning og klassificering af levende bakterier. en, Skematisk af enheden. b, Helpladebillede af E. coli og K. aerogenes kolonier. c, Eksempelbilleder af de individuelle vok
- K2, den lyseste komet i vores solsystem, vil svinge forbi Jorden i denne uge:Her er hvornår du skal…
- Fem fremmedfjendske myter om immigranter i Sydafrika afvist af forskere
- Genplantning af oliepalme kan være drivkraften bag en anden bølge af tab af biodiversitet
- Stråling fra nærliggende galakser hjalp med at brænde de første monster sorte huller, siger unde…
- Sådan fungerer elevatorer
- Satellit finder Tropical Cyclone 03S under udvikling i det sydlige Indiske Ocean


