Er der nogle tips til at skrive redoxreaktioner?
1. Identificer oxidations- og reduktionshalvreaktionerne:
- Opdel den samlede reaktion i to halvreaktioner:en til oxidation og en til reduktion.
- I oxidationshalvreaktionen skal du identificere arten, der bliver oxideret (taber elektroner) og skrive det som en stigning i oxidationstilstanden.
- I reduktionshalvreaktionen skal du identificere arten, der reduceres (vinder elektroner) og skrive det som et fald i oxidationstilstand.
2. Afbalancere antallet af overførte elektroner:
- Sørg for, at antallet af elektroner tabt i oxidationshalvreaktionen er lig med antallet af elektroner opnået i reduktionshalvreaktionen.
3. Balancer atomerne:
- Afbalancere antallet af hver type atom i hver halvreaktion.
- For at afbalancere atomer kan man tilføje koefficienter til arterne i halvreaktionerne.
4. Balancer afgifterne:
- Balancer den samlede ladning af hver halvreaktion ved at tilføje H+ ioner eller OH- ioner, hvis det er nødvendigt.
- I sure opløsninger, brug H+ ioner til at afbalancere ladninger.
- I basisløsninger skal du bruge OH-ioner til at balancere ladninger.
5. Kombiner halvreaktionerne:
- Når halvreaktionerne er afbalanceret, kombineres dem for at få den samlede redoxreaktion.
- Sørg for at gange koefficienterne i halvreaktionerne tilsvarende for at sikre, at den samlede reaktion er afbalanceret.
6. Tjek for nøjagtighed:
- Bekræft, at den samlede reaktion er afbalanceret med hensyn til masse og ladning.
- Sørg for, at reaktanterne og produkterne er korrekt identificeret.
Husk at afbalancering af redoxreaktioner kræver tålmodighed og øvelse. Tøv ikke med at henvise til lærebøger eller onlineressourcer for yderligere vejledning.
Sidste artikelGiver elektroder fugt og hjælper med ledning?
Næste artikelHvilket enzym omdanner pyruvat til acetyl-CoA?
 Varme artikler
Varme artikler
-
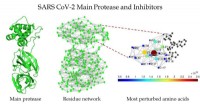 Målretning af SARS-CoV-2-enzym med inhibitorerSkematisk af hovedproteasen af SARS CoV-2 (venstre), proteinrestnetværket af hovedproteasen i SARS CoV-2 (i midten), og en zoomet visning af området omkring bindingsstedet som detekteret af Estrada
Målretning af SARS-CoV-2-enzym med inhibitorerSkematisk af hovedproteasen af SARS CoV-2 (venstre), proteinrestnetværket af hovedproteasen i SARS CoV-2 (i midten), og en zoomet visning af området omkring bindingsstedet som detekteret af Estrada -
 Video:Giver adrenalin dig superheltestyrke?Kredit:The American Chemical Society Du har sikkert hørt historier om mødre, der løfter biler for at redde deres babyer fanget nedenunder - men er det bare bymyter? Denne uge om reaktioner, vi ta
Video:Giver adrenalin dig superheltestyrke?Kredit:The American Chemical Society Du har sikkert hørt historier om mødre, der løfter biler for at redde deres babyer fanget nedenunder - men er det bare bymyter? Denne uge om reaktioner, vi ta -
 Team udvikler innovative, ideelle væskeafvisende overfladerProfessor Wang Liqui (til venstre) og Dr. Zhu Pingan fra HKU Mechanical Engineering Department fremviser det væskeafvisende materiale, de fornyede. Kredit:University of Hong Kong På væskeafvisende
Team udvikler innovative, ideelle væskeafvisende overfladerProfessor Wang Liqui (til venstre) og Dr. Zhu Pingan fra HKU Mechanical Engineering Department fremviser det væskeafvisende materiale, de fornyede. Kredit:University of Hong Kong På væskeafvisende -
 Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet
Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet
- Delikat åbning af et båndgab i grafen muliggør højtydende transistorer
- Pludselige klimaudsving i Tibet som aftryk af flere smeltevandsbegivenheder i begyndelsen til midten…
- Forskere, der arbejder på at genvinde sjældne jordarters grundstoffer og sikre kritiske materialer…
- Lab opdager et lille Cain-and-Abel-molekyle
- Religiøst tilhørsforhold ved livets afslutning er under forandring globalt
- Søg efter usynlig axion mørkt stof med et hulrum med flere celler


