Hvad vil det sige at være en stærk eller svag syrebase?
Styrken af en syre måles ved dens syredissociationskonstant (Ka). Ka er ligevægtskonstanten for dissociationen af en syre i vand. Jo højere Ka, jo stærkere er syren.
Styrken af en base måles ved dens basisdissociationskonstant (Kb). Kb er ligevægtskonstanten for dissociationen af en base i vand. Jo højere Kb, jo stærkere basen.
Stærke syrer og baser har Ka- og Kb-værdier, der er meget større end 1, mens svage syrer og baser har Ka- og Kb-værdier, der er meget mindre end 1.
Her er en tabel, der opsummerer egenskaberne af stærke og svage syrer og baser:
| Ejendom | Stærk syre | Svag syre | Stærk base | Svag base |
|---|---|---|---|---|
| Dissociation | Dissocierer fuldstændigt i vand | Dissocierer delvist i vand | Dissocierer fuldstændigt i vand | Dissocierer delvist i vand |
| Ka | Ka>> 1 | Ka <<1 | Kb>> 1 | Kb <<1 |
| pH | pH <7 | pH> 7 | pH> 7 | pH <7 |
| Eksempler | HCl, H2SO4, HNO3 | CH3COOH, H2CO3, HF | NaOH, KOH, Ca(OH)2 | NH3, CH3NH2, pyridin |
Stærke syrer og baser er typisk ætsende og kan forårsage alvorlige forbrændinger. Svage syrer og baser er generelt mindre skadelige, men de kan stadig forårsage irritation.
Sidste artikelFår salt frugt til ikke at rådne?
Næste artikelHvad vil det sige at have 103 chlorid?
 Varme artikler
Varme artikler
-
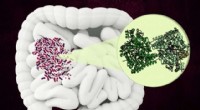 Bakterielt enzym kan blive et nyt mål for antibiotikaMIT-forskere har opdaget strukturen af et usædvanligt enzym, som nogle mikrober bruger til at nedbryde en komponent af kollagen i den menneskelige tarm. Kredit:Christine Daniloff, MIT MIT og Har
Bakterielt enzym kan blive et nyt mål for antibiotikaMIT-forskere har opdaget strukturen af et usædvanligt enzym, som nogle mikrober bruger til at nedbryde en komponent af kollagen i den menneskelige tarm. Kredit:Christine Daniloff, MIT MIT og Har -
 At finde giftige kræftfremkaldende metaller hurtigere i fødevarer og vandKredit:CC0 Public Domain Forskere ved University Johannesburg har udviklet en effektiv og mere følsom metode til at teste for farlige niveauer af tungmetaller som arsen, cadmium og chrom i grøntsa
At finde giftige kræftfremkaldende metaller hurtigere i fødevarer og vandKredit:CC0 Public Domain Forskere ved University Johannesburg har udviklet en effektiv og mere følsom metode til at teste for farlige niveauer af tungmetaller som arsen, cadmium og chrom i grøntsa -
 Behandling af svampe-hornhindeinfektion med syntetiske molekylerEn Candida albicans biofilm før (top) og efter (bund) behandling med et af de syntetiske peptider. Kredit:Ref. 1 © 2017 WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim A*STAR-forskere har skabt syntetis
Behandling af svampe-hornhindeinfektion med syntetiske molekylerEn Candida albicans biofilm før (top) og efter (bund) behandling med et af de syntetiske peptider. Kredit:Ref. 1 © 2017 WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim A*STAR-forskere har skabt syntetis -
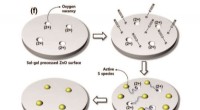 Realisering af farvefilterfri billedsensorerSkematisk mekanisme for S-doping af sol-gel-behandlet ZnO-film. Spin-coated thiocyanation (SCN?) omdannes til aktive S arter ved varmebehandling og migreres til ilt ledige steder ved elektrostatisk kr
Realisering af farvefilterfri billedsensorerSkematisk mekanisme for S-doping af sol-gel-behandlet ZnO-film. Spin-coated thiocyanation (SCN?) omdannes til aktive S arter ved varmebehandling og migreres til ilt ledige steder ved elektrostatisk kr
- Havforsuring forårsager koral osteoporose på ikoniske rev
- Skildpaddeskaller fungerede som symbolske musikinstrumenter for oprindelige kulturer
- Typhons
- Weather Service vinterprognose:Lidt varmere, men kaotisk
- Symbolligning for kaliumhydroxid og salpetersyre?
- Orkanen Dorian bevæger sig mod den amerikanske kyst, da syv dræbte på Bahamas


