Hvordan påvirker syrestyrken elektrisk ledningsevne?
Når en syre opløses i vand, gennemgår den en kemisk reaktion kaldet dissociation, hvor den kovalente binding mellem brint og de sure arter (såsom HCl, H2SO4 osv.) går i stykker, hvilket resulterer i frigivelse af H+ ioner til opløsningen.
Tilstedeværelsen af disse frie H+ ioner er afgørende for elektrisk ledningsevne. H+ ioner er meget mobile og kan bevæge sig frit i opløsningen. Når en spænding påføres, bevæger disse ladede partikler sig mod den modsat ladede elektrode og fører en elektrisk strøm.
Derfor, jo højere koncentrationen af H+ ioner i en opløsning er, jo større er den elektriske ledningsevne. Stærkere syrer dissocierer mere fuldstændigt og frigiver en højere koncentration af H+ ioner, hvilket fører til højere elektrisk ledningsevne. Omvendt dissocierer svagere syrer mindre, hvilket resulterer i en lavere koncentration af H+ ioner og lavere elektrisk ledningsevne.
Sammenfattende påvirker syrestyrken direkte den elektriske ledningsevne. Stærkere syrer, med højere dissociationskonstanter, har højere elektrisk ledningsevne på grund af den øgede koncentration af mobile H+ ioner i opløsningen.
 Varme artikler
Varme artikler
-
 Termisk lagring til energiomstillingALMA-fordampningssystemet giver mulighed for at coate små dele. Kredit:Fraunhofer-Gesellschaft I Tyskland, 55 procent af det endelige energiforbrug går til opvarmning og køling. Imidlertid, meget
Termisk lagring til energiomstillingALMA-fordampningssystemet giver mulighed for at coate små dele. Kredit:Fraunhofer-Gesellschaft I Tyskland, 55 procent af det endelige energiforbrug går til opvarmning og køling. Imidlertid, meget -
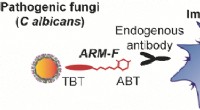 Neutralisering af patogene svampe med småmolekylære immunterapeutikaKredit:Wiley Svampeinfektioner repræsenterer en stigende sundhedskrise, især for immundefekt patienter. Amerikanske forskere rapporterer nu i tidsskriftet Angewandte Chemie at specifik hjælp kun
Neutralisering af patogene svampe med småmolekylære immunterapeutikaKredit:Wiley Svampeinfektioner repræsenterer en stigende sundhedskrise, især for immundefekt patienter. Amerikanske forskere rapporterer nu i tidsskriftet Angewandte Chemie at specifik hjælp kun -
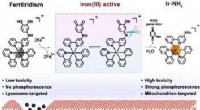 Siger mod mavekræft:Ny tilgang til selektiv kemoterapiKredit:Wiley Et nyt stof, kaldet FerriIridium, kan samtidigt hjælpe med at diagnosticere og behandle mavekræft. Den oprindeligt svagt aktive precursor (prodrug), baseret på en iridiumholdig forbi
Siger mod mavekræft:Ny tilgang til selektiv kemoterapiKredit:Wiley Et nyt stof, kaldet FerriIridium, kan samtidigt hjælpe med at diagnosticere og behandle mavekræft. Den oprindeligt svagt aktive precursor (prodrug), baseret på en iridiumholdig forbi -
 Sy det hele sammen:Inspiration til seje og selvhelbredende materialerGummisegmenter i en båndformet polymermembran gør den superstrækbar. Det har også evnen til at hele sig selv efter et snit eller en pause. Kredit:Pengfei Cao og Bingrui Li/Oak Ridge National Laborator
Sy det hele sammen:Inspiration til seje og selvhelbredende materialerGummisegmenter i en båndformet polymermembran gør den superstrækbar. Det har også evnen til at hele sig selv efter et snit eller en pause. Kredit:Pengfei Cao og Bingrui Li/Oak Ridge National Laborator
- Marsmåner har en fælles forfader
- Facebook forbedrer, hvordan blinde kan "se" billeder ved hjælp af AI
- Forskere tyder elektronernes dynamik i perovskitkrystaller
- Forskere identificerer de mest presserende problemer forårsaget af kemikalier i miljøet
- Solar Orbiter:Forvandler billeder til fysik
- Blokleg kan forbedre dit barns matematiske færdigheder, eksekutiv funktion


