Hvad adskiller eddikesyre til?
Den kemiske ligning for dissociation af eddikesyre kan repræsenteres som følger:
CH3COOH <=> H+ + CH3COO-
I denne ligevægtsreaktion fungerer eddikesyremolekylet (CH3COOH) som den svage syre, der donerer en hydrogenion (H+) for at danne en hydroniumion (H3O+) i opløsning. Acetat-ionen (CH3COO-) er den konjugerede base af eddikesyre.
Graden af dissociation af eddikesyre i vand er relativt lav, hvilket betyder, at kun en lille del af syremolekylerne faktisk dissocierer til ioner. Denne dissociation er dog tilstrækkelig til at give eddikesyre dens karakteristiske sure egenskaber, såsom en sur smag og evnen til at reagere med baser og frigive H+ ioner.
Sidste artikelHvordan kan du identificere keton i en organisk ukendt?
Næste artikelHvad sker der, når saltsyre blandes med hvid cement?
 Varme artikler
Varme artikler
-
 Nye kemiske forbindelser gør katalysatorer mere effektiveForskergruppen fra Bochum:Thorsten Scherpf, Viktoria Daeschlein-Gessner, Lennart Scharf og Christopher Schwarz (fra venstre). Kredit:RUB, Marquard Et team fra Chair of Inorganic Chemistry II ved R
Nye kemiske forbindelser gør katalysatorer mere effektiveForskergruppen fra Bochum:Thorsten Scherpf, Viktoria Daeschlein-Gessner, Lennart Scharf og Christopher Schwarz (fra venstre). Kredit:RUB, Marquard Et team fra Chair of Inorganic Chemistry II ved R -
 Klar, ledende belægning kunne beskytte avancerede solceller, berøringsskærmeSkematisk illustration af PEDOT-syntese ved oCVD-metoden. (A) Det sure skylletrin efter afsætning (f.eks. MeOH eller HBr skylning) bruges generelt til poly(3, 4-ethylen dioxythiophene) (PEDOT) film dy
Klar, ledende belægning kunne beskytte avancerede solceller, berøringsskærmeSkematisk illustration af PEDOT-syntese ved oCVD-metoden. (A) Det sure skylletrin efter afsætning (f.eks. MeOH eller HBr skylning) bruges generelt til poly(3, 4-ethylen dioxythiophene) (PEDOT) film dy -
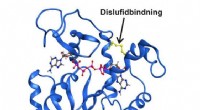 At få øje på det usynligeHøjopløsningsrøntgenstruktur af enzymet adenylatkinase fanget i en forbigående strukturel tilstand af en kovalent disulfidbinding. Kredit:Umeå Universitet Det er lykkedes kemikere ved Umeå Univers
At få øje på det usynligeHøjopløsningsrøntgenstruktur af enzymet adenylatkinase fanget i en forbigående strukturel tilstand af en kovalent disulfidbinding. Kredit:Umeå Universitet Det er lykkedes kemikere ved Umeå Univers -
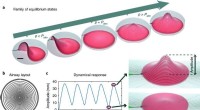 Ved at kombinere pneumatik med en hydrogel for at skabe en baromorf - til blød robotteknologien, Kontinuerlig familie af ligevægtstilstande opnået for en baromorf under forskellige tryk. b, Tilsvarende netværk af kanaler indlejret i pladen. Kanaler er mere koncentrerede i den centrale region
Ved at kombinere pneumatik med en hydrogel for at skabe en baromorf - til blød robotteknologien, Kontinuerlig familie af ligevægtstilstande opnået for en baromorf under forskellige tryk. b, Tilsvarende netværk af kanaler indlejret i pladen. Kanaler er mere koncentrerede i den centrale region
- Facebook, Twitter opfordrede til at gøre mere for politiets had på websteder
- Forskere bruger kobber nanotråde til at bekæmpe spredning af sygdomme
- stoffer i vandet? Giv ikke eleverne skylden
- Hvordan overlever den enpuklede arabiske kamel uden at drikke?
- Undersøgelse:Individer værdsætter information, mens de gør materielle objekter
- 40-års kontrovers i faststoffysik løst


