Hvis en 2,743 g prøve af magnesiumsulfatkrystaller blev opvarmet kraftigt, hvad ville det masseafkølede dehydrerede salt være?
Trin 1:Beregn antallet af mol magnesiumsulfat i prøven på 2,743 g.
Mol af MgSO4 =masse / molær masse
=2,743 g / 120,37 g/mol
=0,0228 mol
Trin 2:Bestem antallet af mol vandmolekyler i det hydrerede magnesiumsulfat.
For hvert mol MgSO4 er der 7 mol vandmolekyler.
Mol vand =7 mol vand / 1 mol MgSO4
=7 x 0,0228 mol
=0,160 mol
Trin 3:Beregn massen af vand tabt under opvarmning.
Molær masse af vand =18,02 g/mol
Tabt vandmasse =Mol vand x Molær vandmasse
=0,160 mol x 18,02 g/mol
=2,883 g
Trin 4:Beregn massen af det afkølede dehydrerede salt.
Masse af afkølet dehydreret salt =Masse af original prøve - Masse af vand tabt
=2,743 g - 2,883 g
=-0,140 g
Den negative værdi indikerer, at massen af det afkølede dehydrerede salt ville være mindre end prøvens oprindelige masse på grund af tab af vandmolekyler under opvarmning.
 Varme artikler
Varme artikler
-
 Når forudsigelser fra teoretiske kemikere bliver til virkelighedHoneycomb-kagome struktur. Kredit:Yu Jing Thomas Heine, professor i teoretisk kemi ved TU Dresden, sammen med sit team, forudsagde først en topologisk 2-D polymer i 2019. Kun et år senere, et inte
Når forudsigelser fra teoretiske kemikere bliver til virkelighedHoneycomb-kagome struktur. Kredit:Yu Jing Thomas Heine, professor i teoretisk kemi ved TU Dresden, sammen med sit team, forudsagde først en topologisk 2-D polymer i 2019. Kun et år senere, et inte -
 Forskere udvikler nye, lavprisværktøj til påvisning af bakterier i mad og vandKredit:University of Massachusetts Amherst Fødevareforsker Lili He og kolleger ved University of Massachusetts Amherst rapporterer, at de har udviklet en ny, hurtig og billig metode til påvisning
Forskere udvikler nye, lavprisværktøj til påvisning af bakterier i mad og vandKredit:University of Massachusetts Amherst Fødevareforsker Lili He og kolleger ved University of Massachusetts Amherst rapporterer, at de har udviklet en ny, hurtig og billig metode til påvisning -
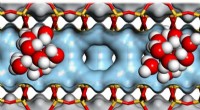 Katalyserer omdannelsen af biomasse til biobrændstofKlynger af vandmolekyler i zeoliternes hulrum hjælper med at katalysere omdannelsen af biomasse til biobrændstof. Kredit:Andreas Jentys / TUM Zeolitter er ekstremt porøse materialer:Ti gram kan
Katalyserer omdannelsen af biomasse til biobrændstofKlynger af vandmolekyler i zeoliternes hulrum hjælper med at katalysere omdannelsen af biomasse til biobrændstof. Kredit:Andreas Jentys / TUM Zeolitter er ekstremt porøse materialer:Ti gram kan -
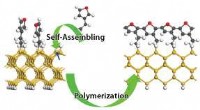 Ny vej til molekylære ledninger egnet til brug i miniaturelektronikEn totrins syntese af molekylære ledninger blev undersøgt ved anvendelse af molekylær modellering. Kredit:Genoptrykt med tilladelse fra Ref 1. Copyright 2016 American Chemical Society Forbrugernes
Ny vej til molekylære ledninger egnet til brug i miniaturelektronikEn totrins syntese af molekylære ledninger blev undersøgt ved anvendelse af molekylær modellering. Kredit:Genoptrykt med tilladelse fra Ref 1. Copyright 2016 American Chemical Society Forbrugernes
- Borat bioaktivt glas i nanoskala:Et næste generations materiale til hudheling
- Sådan konverteres centimeter til kubiske fødder
- Nanowire-resonatorer kan bruges til at miniaturisere energieffektiv elektronik
- Udforske det sociale i skolealderen, følelsesmæssig, og adfærdsmæssigt sundhedslandskab
- Cellemembranproteiner afbildet i 3-D
- Hvad er affaldsproduktet fra fotosyntese?


