Cellemembranproteiner afbildet i 3-D
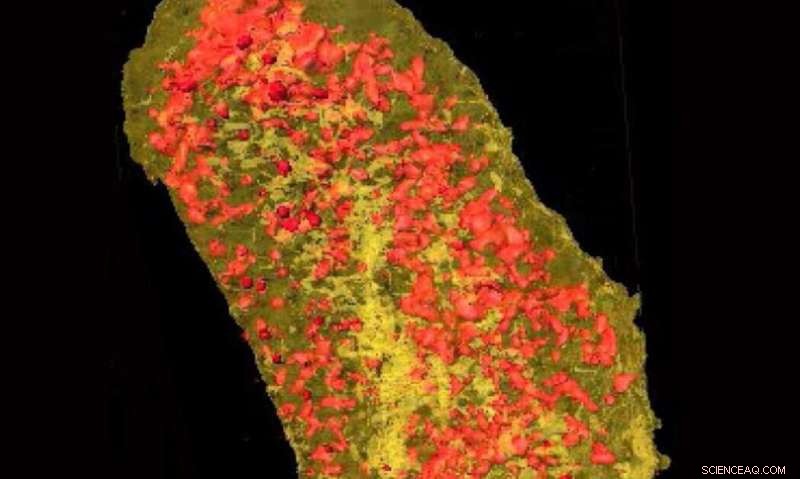
Ultralyse røntgenbilleder afslørede koncentrationen af erbium (gul) og zink (rød) i en enkelt E.coli-celle, der udtrykker et lanthanid-bindende mærke og inkuberet med erbium. Kredit:Brookhaven National Laboratory
Et team af forskere, herunder forskere ved National Synchrotron Light Source II (NSLS-II) - et US Department of Energy (DOE) Office of Science User Facility ved DOE's Brookhaven National Laboratory - har demonstreret en ny teknik til billeddannelse af proteiner i 3-D med opløsning i nanoskala. Deres arbejde, offentliggjort i Journal of the American Chemical Society , gør det muligt for forskere at identificere den præcise placering af proteiner i individuelle celler, når opløsningen af cellemembranen og de mindste subcellulære organeller.
"I den strukturelle biologiske verden, forskere bruger teknikker som røntgenkrystallografi og kryo-elektronmikroskopi til at lære om proteiners præcise struktur og udlede deres funktioner, men vi lærer ikke, hvor de fungerer i en celle, " sagde den tilsvarende forfatter og NSLS-II videnskabsmand Lisa Miller. "Hvis du studerer en bestemt sygdom, du skal vide, om et protein fungerer det forkerte sted eller slet ikke."
Den nye teknik udviklet af Miller og hendes kolleger ligner i stilen traditionelle metoder til fluorescensmikroskopi i biologi, hvor et molekyle kaldet grønt fluorescerende protein (GFP) kan bindes til andre proteiner for at afsløre deres placering. Når GFP udsættes for UV eller synligt lys, det fluorescerer en lys grøn farve, belysning af et ellers "usynligt" protein i cellen.
"Ved at bruge GFP, vi kan se, om et protein er i subcellulære strukturer, der er hundredvis af nanometer store, som kernen eller cytoplasmaet, "Miller sagde, "men strukturer som en cellemembran, som kun er syv til 10 nanometer i størrelse, er svære at se med synlige lys-tags som GFP. For at se strukturer på størrelse med 10 nanometer i en celle, du har stor gavn af brugen af røntgenstråler."
For at overkomme denne udfordring, forskere ved NSLS-II gik sammen med forskere ved Massachusetts Institute of Technology (MIT) og Boston University (BU), som udviklede et røntgenfølsomt mærke kaldet et lanthanid-bindende mærke (LBT). LBT'er er meget små proteiner, der kan binde tæt til grundstoffer i lanthanid-serien, såsom erbium og europium.
"I modsætning til GFP, som fluorescerer, når de udsættes for UV eller synligt lys, lanthanider fluorescerer i nærvær af røntgenstråler, " sagde hovedforfatter Tiffany Victor, en forskningsmedarbejder ved NSLS-II. "Og da lanthanider ikke forekommer naturligt i cellen, når vi ser dem med røntgenmikroskopet, vi kender placeringen af vores protein af interesse."
Forskerne ved NSLS-II, MIT, og BU arbejdede sammen om at kombinere LBT-teknologi med røntgenfluorescens.
"Selvom LBT'er er blevet brugt flittigt i det sidste årti, de er aldrig blevet brugt til røntgenfluorescensundersøgelser, " sagde Miller.
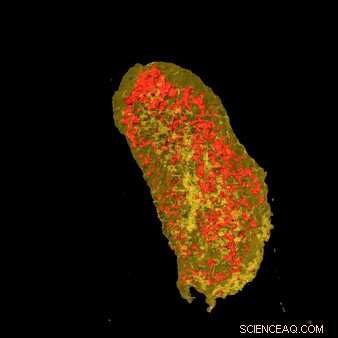
Ultralyse røntgenbilleder afslørede koncentrationen af erbium (gul) og zink (rød) i en enkelt E.coli-celle, der udtrykker et lanthanid-bindende mærke og inkuberet med erbium. Kredit:Brookhaven National Laboratory
Udover at få billeder i højere opløsning, Røntgenfluorescens giver samtidig kemiske billeder på alle sporstoffer i en celle, såsom calcium, kalium, jern, kobber, og zink. I andre undersøgelser, Millers team forsker i, hvordan sporstoffer som kobber er forbundet med neurondød i sygdomme som Alzheimers. Visualisering af placeringen af disse elementer i forhold til specifikke proteiner vil være nøglen til nye fund.
Ud over deres kompatibilitet med røntgenstråler, LBT'er er også gavnlige for deres relativt lille størrelse, sammenlignet med synlige lysmærker.
"Forestil dig, at du havde en hale fastgjort til dig, der var på størrelse med hele din krop, eller større, " sagde Miller. "Der ville være en masse normale aktiviteter, som du ikke længere ville være i stand til at udføre. Men hvis du kun skulle gå rundt med en lille grisehale, du kunne stadig løbe, hoppe, og passer gennem døråbninger. GFP er ligesom den store hale - det kan være en reel hindring for funktionen af mange proteiner. Men disse små lanthanid-bindende tags er næsten usynlige."
For at demonstrere brugen af LBT'er til billeddannelse af proteiner i 3-D med opløsning i nanoskala, forskerne ved MIT og BU mærkede to proteiner i en bakteriecelle - et cytoplasmatisk protein og et membranprotein. Derefter, Millers team studerede prøven ved Hard X-ray Nanoprobe (HXN) beamline ved NSLS-II og Bionanoprobe beamline ved Advanced Photon Source (APS) - en DOE Office of Science User Facility ved DOE's Argonne National Laboratory.
"HXN tilbyder verdens førende røntgenfokusstørrelse, hvilket går ned til omkring 12 nanometer. Dette var afgørende for billeddannelse af bakteriecellen i 3-D med opløsning i nanoskala, " sagde Yong Chu, ledende strålelinjeforsker ved HXN. "Vi udviklede også en ny måde at montere cellerne på en specialiseret prøveholder for at optimere effektiviteten af målingerne."
Ved at koble den uovertrufne opløsning af HXN med mulighederne fra LBT'er, holdet var i stand til at afbilde begge de mærkede proteiner. Visualisering af cellemembranproteinet beviste LBT'er kan ses i en høj opløsning, mens billeddannelse af det cytoplasmatiske protein viste, at LBT'er også kunne visualiseres i cellen.
"Ved høje koncentrationer, lanthanider er giftige for celler, Victor sagde, "så det var vigtigt for os at vise, at vi kunne behandle celler med en meget lav lanthanidkoncentration, der var ugiftig og betydelig nok til at komme forbi cellemembranen og afbilde de proteiner, vi ønskede at se."
Nu, med denne nye teknik demonstreret med succes, forskere håber at kunne bruge LBT'er til at afbilde andre proteiner i cellen med en opløsning på 10 nanometer.
 Varme artikler
Varme artikler
-
 Forbindelse fra lægeurt dræber hjerneædende amøber i laboratorieundersøgelserBlade fra Inula viscosa , en flerårig middelhavsbusk, indeholder en forbindelse, der dræber hjerneædende amøber. Kredit:Tilpasset fra ACS Chemical Neuroscience 2020, DOI:10.1021/acschemneuro.0c006
Forbindelse fra lægeurt dræber hjerneædende amøber i laboratorieundersøgelserBlade fra Inula viscosa , en flerårig middelhavsbusk, indeholder en forbindelse, der dræber hjerneædende amøber. Kredit:Tilpasset fra ACS Chemical Neuroscience 2020, DOI:10.1021/acschemneuro.0c006 -
 Undersøgelse tilbyder ny indsigt i solopsamlingsteknologierCover af ACS Applied Energy Materials, der viser en katalysatormodificeret solcelle, der producerer brintbrændstof under forskellige lysforhold. Kredit:Grafisk af Jason Drees Hver time, solen mætt
Undersøgelse tilbyder ny indsigt i solopsamlingsteknologierCover af ACS Applied Energy Materials, der viser en katalysatormodificeret solcelle, der producerer brintbrændstof under forskellige lysforhold. Kredit:Grafisk af Jason Drees Hver time, solen mætt -
 Hvorfor barbering gør selv de skarpeste barbermaskiner sløveKredit:Unsplash/CC0 Public Domain Barbermaskiner, skalpeller, og knive er normalt fremstillet af rustfrit stål, slebet til en knivskarp kant og belagt med endnu hårdere materialer såsom diamantlig
Hvorfor barbering gør selv de skarpeste barbermaskiner sløveKredit:Unsplash/CC0 Public Domain Barbermaskiner, skalpeller, og knive er normalt fremstillet af rustfrit stål, slebet til en knivskarp kant og belagt med endnu hårdere materialer såsom diamantlig -
 Forskere gør vanadium til en nyttig katalysator til hydrogeneringArgonne -kemiker Max Delferro har udviklet en usædvanlig aktiv form for vanadium til hydrogeneringsreaktioner. Vanadium er et billigt almindeligt metal, der kan erstatte nogle af de ædle metaller, der
Forskere gør vanadium til en nyttig katalysator til hydrogeneringArgonne -kemiker Max Delferro har udviklet en usædvanlig aktiv form for vanadium til hydrogeneringsreaktioner. Vanadium er et billigt almindeligt metal, der kan erstatte nogle af de ædle metaller, der
- Jack Ma, Grib øje muligheder i Singapore digital bank kamp
- Survival of the fittest og mest adrætte vil gøre eller ødelægge detailhandlere, efterhånden som…
- Daimler -overskud ramt af dieselskandale
- Verden ser til, mens Californien overvejer kontroversiel plan for at redde tropiske skove
- Sådan smeltes glas med en fakkel
- Svampemikrober som biogødning i landbrug og havearbejde - er belønningen større end risikoen?


