Hvad er karakteren af ikke-metaloxid?
1. Kovalent binding :Ikke-metaloxider dannes ved den kovalente binding mellem ikke-metalatomer. Elektronegativitetsforskellen mellem ikke-metaller er normalt signifikant, hvilket resulterer i dannelsen af polære kovalente bindinger. For eksempel i kuldioxid (CO2) deler oxygenatomerne elektroner med kulstofatomet for at danne to dobbeltbindinger, hvilket resulterer i et stabilt molekyle.
2. Molekylær struktur :Ikke-metaloxider har typisk molekylære strukturer, hvilket betyder, at atomerne er arrangeret i diskrete molekyler i stedet for et udvidet gitter. Disse molekyler kan være diatomiske (bestående af to atomer), polyatomiske (bestående af mere end to atomer) eller endda komplekse molekylære strukturer. For eksempel er kuldioxid (CO2) et diatomisk molekyle, mens svovltrioxid (SO3) er et polyatomisk molekyle med en trigonal pyramidestruktur.
3. Sur eller neutral natur :Ikke-metaloxider kan udvise forskellig kemisk adfærd afhængigt af deres egenskaber. Mange ikke-metaloxider reagerer med vand og danner syrer. Disse er kendt som sure oxider. For eksempel reagerer kuldioxid (CO2) med vand og danner kulsyre (H2CO3), mens svovldioxid (SO2) danner svovlsyrling (H2SO3). Nogle ikke-metaloxider er dog neutrale og reagerer ikke med vand. For eksempel undergår kulilte (CO) ingen reaktion med vand.
4. Opløselighed :Ikke-metaloxider viser varieret opløselighed i vand. Nogle ikke-metaloxider, såsom kuldioxid og svovldioxid, er opløselige i vand. Når de er opløst i vand, kan de danne sure opløsninger. I modsætning hertil er andre ikke-metaloxider, såsom siliciumdioxid (SiO2), uopløselige i vand.
5. Reaktivitet :Ikke-metaloxider kan udvise en række reaktiviteter. Nogle ikke-metaloxider er ret reaktive og kan let gennemgå kemiske reaktioner, mens andre er relativt inerte. For eksempel er carbonmonoxid (CO) en reaktiv gas, der let kombineres med oxygen for at danne carbondioxid, mens siliciumdioxid (SiO2) er et meget ureaktivt fast stof.
Samlet set udviser ikke-metaloxider forskellige egenskaber på grund af deres varierende kemiske sammensætning og bindingsegenskaber. Deres kovalente natur, molekylære strukturer, sure eller neutrale adfærd, opløselighed i vand og reaktivitet bidrager til deres unikke roller i kemiske reaktioner og forskellige anvendelser inden for forskellige områder af videnskab og industri.
Sidste artikelSplintres svovl, når det bliver ramt?
Næste artikelIlt og kobber er eksempler på hvad?
 Varme artikler
Varme artikler
-
 Fra bronzealderen til maddåser, her er hvordan tin ændrede menneskehedenTin kommer fra malmen cassiterit. Kredit:Shutterstock/PYP Nævn tin, og de fleste mennesker ville tænke på den typiske blikdåse, bruges til at konservere fødevarer, du opbevarer i dine skabe. Tin b
Fra bronzealderen til maddåser, her er hvordan tin ændrede menneskehedenTin kommer fra malmen cassiterit. Kredit:Shutterstock/PYP Nævn tin, og de fleste mennesker ville tænke på den typiske blikdåse, bruges til at konservere fødevarer, du opbevarer i dine skabe. Tin b -
 En teoretisk undersøgelse forklarer det naturlige udvalg af proteinerKunstnerisk repræsentation af sekvensudvælgelsen efter temperatur for et hydratiseret protein. Kredit:V. Bianco Forskere fra Institute of Nanoscience and Nanotechnology ved University of Barcelona
En teoretisk undersøgelse forklarer det naturlige udvalg af proteinerKunstnerisk repræsentation af sekvensudvælgelsen efter temperatur for et hydratiseret protein. Kredit:V. Bianco Forskere fra Institute of Nanoscience and Nanotechnology ved University of Barcelona -
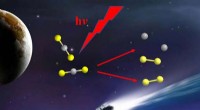 Dalian Coherent Light Source afslører oprindelsen af interstellar disulfurForskere observerede direkte C + S2-kanalen i CS 2 fotodissociation. Kredit:LI Zhenxing At studere skabelsen og udviklingen af svovlholdige forbindelser i det ydre rum er afgørende for at fors
Dalian Coherent Light Source afslører oprindelsen af interstellar disulfurForskere observerede direkte C + S2-kanalen i CS 2 fotodissociation. Kredit:LI Zhenxing At studere skabelsen og udviklingen af svovlholdige forbindelser i det ydre rum er afgørende for at fors -
 Forskere kommer op med nanobeton til støbning under negative temperaturforholdEt nærbillede af kæmpe stilladser på byggepladsen til bygning af det nye Kommunebibliotek. Til venstre er de tykke lag af stilladser nødvendige for at understøtte den forreste vandrette frontfacade. K
Forskere kommer op med nanobeton til støbning under negative temperaturforholdEt nærbillede af kæmpe stilladser på byggepladsen til bygning af det nye Kommunebibliotek. Til venstre er de tykke lag af stilladser nødvendige for at understøtte den forreste vandrette frontfacade. K
- Gasserne på titan er alle ionisk bundet sandt eller falsk?
- Kirigami/origami:udfolder det nye regime med avanceret 3-D mikro-/nanofabrikation med foldning
- Stigning i skovbrande, der forårsager dårlige luftdage i det nordvestlige USA til at blive værre …
- Ydmygende, smertefuld, deprimerende:brutale realiteter ved sofasurfing
- The Lovers Tarot Card Betydning:Kærlighed, liv og timing
- Arktisk kold krig:klimaændringer har antændt en ny polar magtkamp


