Hvad skete der med natriumchloridkrystallerne, når der blev tilsat 5 ml vand?
1. Opløsning:Natriumchloridkrystallerne begynder at opløses i vandet. Vandmolekylerne omgiver de individuelle natrium- og chloridioner og bryder de ionbindinger, der holder krystalgitteret sammen. Denne proces er kendt som dissociation.
2. Hydration:Efterhånden som natrium- og chloridionerne frigives til vandet, bliver de omgivet af vandmolekyler. Denne proces kaldes hydrering. Vandmolekylerne interagerer med ionerne gennem elektrostatiske kræfter, der danner et lag af vandmolekyler omkring hver ion.
3. Dannelse af vandigt natriumchlorid:Efterhånden som flere og flere natriumchloridkrystaller opløses, stiger koncentrationen af natrium- og chloridioner i vandet. Dette resulterer i dannelsen af en vandig opløsning af natriumchlorid, almindeligvis kendt som saltvand eller saltvand.
4. Forsvinden af krystaller:Efterhånden som natriumchloridkrystallerne fortsætter med at opløses, forsvinder de gradvist. De enkelte ioner bliver spredt i vandet, og den faste krystalstruktur er ikke længere synlig.
5. Homogen blanding:Den resulterende opløsning er homogen, hvilket betyder, at natriumchloridet er ensartet fordelt i hele vandet. Opløsningen fremstår klar og gennemsigtig uden synlige faste partikler.
Sammenfattende, når natriumchloridkrystaller tilsættes til 5 ml vand, opløses de og dissocieres til individuelle natrium- og chloridioner, som bliver hydreret og dispergeret i vandet og danner en homogen vandig opløsning af natriumchlorid.
 Varme artikler
Varme artikler
-
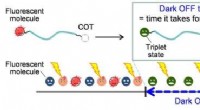 Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik.
Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik. -
 Design af hierarkiske nanoporøse membraner til højeffektive adsorptions- og opbevaringsapplikation…Fotografier af de hierarkiske nanoporøse membraner, der er skabt ved hjælp af en coatingbladsmetode. EN, Fotografi af stort område HNM (10 × 10 cm2) fremstillet ved en rakel-metode. B, Fotografi af fr
Design af hierarkiske nanoporøse membraner til højeffektive adsorptions- og opbevaringsapplikation…Fotografier af de hierarkiske nanoporøse membraner, der er skabt ved hjælp af en coatingbladsmetode. EN, Fotografi af stort område HNM (10 × 10 cm2) fremstillet ved en rakel-metode. B, Fotografi af fr -
 Forskere foreslår en ny metode til storskala produktion af termisk stabile enkeltatomkatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. Qiao Botao fra Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi har foreslået en ny metode til storskala pro
Forskere foreslår en ny metode til storskala produktion af termisk stabile enkeltatomkatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. Qiao Botao fra Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi har foreslået en ny metode til storskala pro -
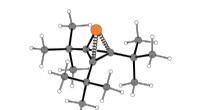 Fjederbelastet system sætter fosfor ind i molekylære ringeBilledtekst:MIT-kemikere opdagede en måde at inkorporere fosfor i tre-leddede ringforbindelser ved at bruge dette fjederbelastede molekyle som kilden til fosfor. Kreditering:Udlånt af forskerne MIT
Fjederbelastet system sætter fosfor ind i molekylære ringeBilledtekst:MIT-kemikere opdagede en måde at inkorporere fosfor i tre-leddede ringforbindelser ved at bruge dette fjederbelastede molekyle som kilden til fosfor. Kreditering:Udlånt af forskerne MIT
- En ny krydskobling forenkler syntesen af lægemiddellignende molekyler
- Skoler er kvarterernes 'hubs og hjerter'. Her er, hvordan de kan styrke fællesskaber omkring dem
- Efter Nobelprisen, store ting planlagt for grafen
- Hvilken slags lyd laver en ugle om natten?
- Hvad er intensitet i lyd?
- Forskere siger, at fossil viser mennesker, hunde levede i C. Amerika i 10, 000 f.Kr


